Neoplasia Prostata
- INTRODUZIONE
- EPIDEMIOLOGIA
- Fattori di Rischio
- Fattori Protettivi
- DIAGNOSI
-
Esplorazione Rettale
-
Dosaggio del PSA
- Ecografia Transrettale
-
Risonanza Magnetica (RM)
-
PETTC
- Agobiopsia Prostatica
-
Biopsia Cognitiva
-
Fusion Biopsy
-
-
-
La Prostatectomia Radicale (PR)
- La Radioterapia a Fasci Esterni (RT)
-
In Italia il carcinoma della prostata è attualmente la neoplasia più frequente tra i maschi e rappresenta oltre il 20% di tutti i tumori diagnosticati a partire dai 50 anni di età. Per quanto riguarda la mortalità, occupa il terzo posto nella scala della mortalità, nella quasi totalità dei casi riguardando maschi al di sopra dei 70 anni. Si tratta comunque di una causa di morte in costante moderata diminuzione. La sopravvivenza dei pazienti con carcinoma prostatico, non considerando la mortalità per altre cause, è attualmente attestata al 92% a 5 anni dalla diagnosi, in costante e sensibile crescita. Sebbene la prostata sia stata descritta per la prima volta dall’anatomista veneziano Niccolò Massa nel 1536, e illustrata dal fiammingo Andrea Vesalio nel 1538, il tumore prostatico non venne identificato prima del 1853. Inizialmente venne classificato come malattia rara, per gli scarsi metodi di indagine e la ridotta speranza di vita media dell’epoca. I primi trattamenti messi in atto furono interventi chirurgici per risolvere l’ostruzione urinaria. La prostatectomia radicale perineale venne eseguita per la prima volta nel 1904 da Hugh Young al Johns Hopkins Hospital. La rimozione chirurgica dei testicoli, orchiectomia, come trattamento venne eseguita nel 1890 (infra Terapia ormonale), ma con successo limitato. La prostatectomia radicale retropubica venne messa a punto nel 1983 da Patrick Walsh. Questo approccio chirurgico consentì la rimozione della prostata e dei linfonodi col mantenimento della funzionalità erettile del pene.
Nel 1941 Charles B. Huggins pubblicò uno studio di utilizzo di estrogeni per contrastare la produzione di testosterone in pazienti con tumore prostatico metastatico. La scoperta di questa terapia valse a Huggins nel 1966 il Nobel per la Medicina. Il ruolo del GnRH in ambito riproduttivo venne stabilito da Andrzej W. Schally e Roger Guillemin, che per questo vinsero il Nobel per la Medicina nel 1977; vennero quindi sviluppati e utilizzati in terapia gli agonisti per i recettori del GnRH.
La radioterapia per il tumore prostatico venne sviluppata agli inizi del XX secolo e inizialmente consisteva nell’impianto intraprostatico di radio. La radioterapia a fascio esterno fu più utilizzata quando alla metà del XX secolo divennero disponibili fonti di radiazioni più potenti. La brachiterapia con l’impianto di “semi” fu descritta per la prima volta nel 1983. La chemioterapia sistemica per il tumore della prostata venne studiata per la prima volta negli anni settanta. Al protocollo iniziale con ciclofosfamide 5-fluorouracile ben presto si aggiunsero molteplici altri con un’ampia gamma di farmaci sistemici.
Non vi è dubbio che l’eziologia del carcinoma prostatico sia multifattoriale e sia il risultato di una complessa interazione tra fattori genetici di suscettibilità (responsabili della familiarità e della diversa incidenza nelle razze umane) ed ambientali (dieta, cancerogeni presenti nell’ambiente).

Fattori di rischio:
- Età (l’incidenza del tumore aumenta con l’età)
- Razza (la razza nera è più a rischio per i più elevati livelli circolanti di androgeni, di DHT e di 5-alfa reduttasi.
- Fattori ormonali (elevati livelli circolanti di testosterone e di IGF-1 predispongono all’insorgenza del tumore).
- Storia familiare di tumore della prostata
- Fattori genetici
- Stile di vita: dieta (eccessivo apporto calorico e di grassi).
- Obesità
- Altezza
- Fumo
- Consumo di prodotti caseari
Fattori protettivi:
- Attività fisica
- Consumo di caffè
- Consumo di pomodorii
- Consumo di pesce
- Vitamina D
- Uso di statine
La diagnosi di carcinoma prostatico si basa essenzialmente sulle seguenti indagini:
- Esplorazione Rettale
L’esplorazione rettale (ER) deve costituire il primo approccio diagnostico al paziente che presenti sintomatologia riferibile ad una possibile patologia prostatica. Sebbene indispensabile nella valutazione del paziente, l’ER non può essere utilizzata singolarmente come unica metodica diagnostica, in quanto presenta bassi livelli di sensibilità (valore predittivo positivo) e specificità.
- Dosaggio del PSA
Il PSA è una glicoproteina prodotta principalmente dal tessuto ghiandolare prostatico secreta nel liquido seminale e rilasciata nel sangue solo in quantità minime in condizioni fisiologiche. Il sovvertimento della normale istoarchitettura prostatica in caso di patologia benigna o maligna della prostata, determina un incremento dei livelli ematici di PSA, che deve essere pertanto considerato un marcatore di patologia prostatica. Il valore soglia tradizionalmente utilizzato di 4 ng/ml deve essere considerato convenzionale ed è caratterizzato da un basso valore predittivo, sia positivo che negativo. Fra gli approcci impiegati per migliorare l’accuratezza diagnostica del PSA sono di interesse la PSA velocity, la PSA density e il rapporto PSA libero/totale, chiamati convenzionalmente “derivati del PSA”.
La PSA velocity esprime il tasso di incremento del PSA nel tempo e avrebbe la capacità di predire l’insorgenza del cancro con significativo anticipo diagnostico rispetto al superamento del valore soglia e sarebbe anche un potenziale indicatore di aggressività della neoplasia. Tuttavia, altre evidenze non confermano il valore diagnostico né il significato prognostico della PSA. La ragione per cui studi diversi condotti da gruppi di ricerca autorevoli conducono a risultati e a conclusioni diverse sulla PSA velocity è da ricercare nel problema della standardizzazione. Numerose variabili possono, infatti, condizionare la PSA velocity; fra esse: il livello iniziale di PSA, i criteri usati per la diagnosi, il tipo di studio (associativo o classificativo), la lunghezza del periodo di osservazione, l’intervallo fra i prelievi, la variabilità spontanea del PSA, l’algoritmo di calcolo. La PSA velocity manca quindi ancora del necessario livello di standardizzazione.Conseguentemente, la posizione delle linee guida che danno indicazioni su questa variabile è in parte contraddittoria. In ogni caso, la PSA velocity non dovrebbe essere presa in considerazione nei casi con valori di PSA < 2.0 o > 10.0 ng/mL.
La PSA density (PSAD) esprime il rapporto tra PSA circolante e dimensioni della ghiandola misurate ecograficamente e si basa sull’osservazione che la quantità di PSA prodotto e rilasciato in circolo per grammo di tessuto ghiandolare è molto superiore nel cancro rispetto all’ipertrofia prostatica. L’interpretazione di tale rapporto è condizionata da diverse variabili (es. possibile imprecisione nella determinazione ecografica del volume prostatico, differente rapporto nei singoli individui tra tessuto ghiandolare, che produce PSA, e stroma, che non lo produce) che vanno considerate nella interpretazione del risultato. Ciononostante, numerose evidenze mostrano che la PSAD ha un’accuratezza diagnostica migliore del PSA totale e ha performance simili al rapporto PSA libero/totale nei casi con PSA totale fra 4 e 10 ng/mL. Va sottolineato che nei pazienti con PSA totale basso (es. fra 2 e 4 ng/mL), nei quali la determinazione del PSA libero può essere meno precisa, la PSAD ha un’accuratezza diagnostica migliore del rapporto PSA libero/totale.
Il rapporto PSA libero/totale è stato ampiamente studiato e viene diffusamente usato nella pratica clinica. Il valore cut-off ottimale al di sotto del quale una biopsia dovrebbe essere effettuata, tuttavia, non è ancora condiviso. La revisione della letteratura ha inoltre ridimensionato il valore del rapporto PSA libero/totale, che manterrebbe una buona capacità discriminante per la neoplasia solo nei suoi valori estremi (quando inferiore al 7% nei casi con PSA totale fra 4 e 10 ng/ml), risultando quindi potenzialmente utile in una percentuale ridotta di pazienti.
Nelle ultime due decadi sono state studiate numerose isoforme di PSA, alcune delle quali mostrerebbero un’elevata specificità per il carcinoma della prostata. Fra esse la più estesamente valutata è il [−2]proPSA. Il risultato del [−2]proPSA è comunemente espresso attraverso un indice denominato Prostate Health Index (phi), calcolato mediante un algoritmo che include PSA totale e PSA libero . I risultati dei diversi studi sul [−2]proPSA, complessivamente considerati, portano a concludere che il [−2]proPSA, e in particolare il phi, hanno una migliore performance diagnostica nei casi con PSA fra 2 e 10 ng/mL rispetto ai derivati del PSA e al rapporto PSA libero/. Inoltre, alcuni studi mostrano un’associazione fra il [−2]proPSA e l’aggressività della malattia
Attenzione però che il PSA può essere elevato in circolo non solo in presenza del cancro della prostata, ma anche in condizioni fisiologiche (es. eiaculazione recente, attività fisica intensa), in caso di patologia benigna (es. ipertrofia prostatica, prostatite, infarto prostatico, ritenzione urinaria), nonché dopo l’esecuzione di alcune manovre diagnostiche, quali la cistoscopia o la biopsia prostatica
Tecniche di Immagini
- Ecografia Transrettale: L’ecografia prostatica transrettale è un esame diagnostico che si esegue con l’ausilio di una sonda ecografica lubrificata che viene inserita nell’ampolla rettale del paziente con l’obiettivo diverificare le dimensioni e la morfologia della prostata, nonché di valutare la presenza di eventuali lesioni o formazioni anomale, che potrebbero indicare patologie neoplastiche (tumori). La sonda ecografica emette onde sonore ad alta frequenza, del tutto innocue per la salute del paziente. Con l’ausilio di un elaboratore informatico, la sonda ecografica permette di captare l’intensità degli ultrasuoni riflessi, trasformandoli prima in segnali elettrici e poi in immagini che vengono riprodotte sull’apposito schermo. Studi statistici hanno rilevato che circa il 70% dei carcinomi sono localizzati nella zona periferica per lo più posteriore e si presentano come aree ipoecogene (scure) rispetto alla restante struttura della ghiandola. Esiste una certa percentuale di carcinomi (25-30%) che hanno una struttura molto simile a quella della prostata (isoecogeni) e che quindi non sono facilmente evidenziabili con la sola ecografia di base. Negli stadi più avanzati le aree di neoplasia tendono ad essere iperecogene (più chiare) rispetto alla ghiandola per verosimile aumento della componente fibrosa. I noti limiti dell’ecografia transrettale (TransRectal UltraSound, TRUS) sono legati al fatto che, sebbene la maggior parte dei carcinomi prostatici si configuri come lesioni ipoecogene, non si può trascurare la possibile iperecogenicità di alcune forme di carcinoma della prostata e che un’elevata percentuale di carcinomi sono di aspetto isoecogeno, anche se localizzati nella parte periferica (circa il 40%).
- Risonanza Magnetica (RM): La risonanza magnetica della prostata rappresenta una particolare tipologia di esame RM, che prevede l’acquisizione di multiple immagini della prostata, ciascuna delle quali fornisce differenti informazioni anatomiche, strutturali e funzionali. L’ormai consolidato protocollo multiparametrico, che prevede sequenze anatomiche T2-pesate, T1-pesate in perfusione (Dynamic Contrast Enhanced Magnetic Resonance Imaging, DCE-MRI) e pesate in diffusione (Diffusion Weighted Imaging, DWI) è in grado di fornire una combinazione di informazioni anatomiche, biologiche e funzionali necessarie per una più precisa definizione delle lesioni sospette. Per lo studio multiparametrico della prostata con RM è necessario uno specifico equipaggiamento, con apparecchiatura RM di ultima generazione, operante ad elevata intensità di campo magnetico (almeno 1,5 Tesla), e con una specifica dotazione hardware e software. Data la complessità dell’esame, sono state codificate delle linee guida internazionali, definite PI-RADS, per l’esecuzione e la refertazione dell’esame mpMRI della prostata, che permettono una valutazione oggettiva delle lesioni prostatiche, assegnando loro un punteggio compreso tra 1 e 5, che rappresenta un indice di probabilità che la lesione costituisca una neoplasia prostatica aggressiva; maggiore è il punteggio PIRADS, maggiore è la probabilità che il nodulo sospetto sia un tumore maligno. La mpMRI è oggi considerata la metodica di Diagnostica per Immagini più efficace nello studio della prostata, in grado di ottenere ottimi risultati nell’individuazione delle neoplasie prostatiche significative, cioè delle forme neoplastiche aggressive. A questo proposito, la letteratura internazionale riporta un’accuratezza della mpMRI compresa tra l’84% e il 90%; il dato più significativo della RM prostatica è l’elevato valore predittivo negativo (94%), il che significa che se l’esame è negativo vi è un’elevata probabilità di non avere una neoplasia prostatica aggressiva.
- PETTC: La PET/TC è uno degli esami di diagnostica per immagini più innovativi. Questo esame viene fatto attraverso una macchina che unisce due diverse tecnologie: PET (dall’inglese Positron Emission Tomography, cioè Tomografia ad Emissione di Positroni) e TC (dall’inglese Computed Tomography, cioè Tomografia Computerizzata, anche conosciuta in passato come TAC). Più promettente sembrerebbe il ruolo in fase di stadiazione della PET/TC con PSMA, al punto che in alcuni centri questa metodica ha soppiantato l’imaging tradizionale. Il 68-Gallio PSMA è un radiofarmaco per i tumori della prostata, recentemente descritto in Farmacopea Europea. La PET con 68-Gallio PSMA è una metodica che garantisce una maggiore precisione nello studio di questa patologia: il PSMA, infatti, è un antigene di membrana specifico per la prostata, presente in grande quantità sulla superficie delle cellule tumorali della neoplasia prostatica e quindi è un marker ideale per individuare le cellule tumorali attraverso la PET. Marcando dunque questo antigene con il gallio-68 le sedi di malattia metastatica possono essere individuate con precisione e più precocemente.
- Agobiopsia Prostatica: Sulla base delle evidenze scientifiche, l’indicazione alla esecuzione di biopsia prostatica per la diagnosi mediante esame istopatologico, attualmente viene formulata sulla base del sospetto clinico e/o laboratoristico (alterazioni patologiche dei biomarker ovvero il PSA in primis o la presenza di mutazioni in alcuni geni come BRCA1 e BRCA2, già coinvolti nell’insorgenza di tumori di seno e ovaio, o della Sindrome di Lynch, tumore del colon non poliposico ereditario, HNPCC) e/o ad un esito positivo della RMmp o della ecografia transrettale, oltre che ad un sospetto emerso alla esplorazione digitorettale . Va sottolineato che, vista l’importanza dell’accertamento diagnostico e di tutto ciò che può far seguito alla diagnosi di neoplasia, prima di sottoporre un paziente a biopsia prostatica è sempre utile valutare l’età del paziente, la presenza di eventuali comorbidità e le possibili conseguenze che la diagnosi stessa potrebbe comportare in funzione delle effettive risorse terapeutiche disponibili. E’ necessaria quindi un’attenta preparazione del paziente mediante la valutazione della coagulazione (PT, aPTT, fibrinogeno, piastrine) che devono sempre essere eseguiti prima della biopsia, per valutare il rischio di sanguinamento durante e dopo la procedura. Nel caso di pazienti che assumono una terapia antiaggregante (come la Cardioaspirina) o una terapia anticoagulante (come il Warfarin), questa va sospesa diversi giorni prima dalla biopsia e ripristinata a distanza di almeno 12 ore dal termine della procedura. Oltre al rischio di sanguinamento, esiste il rischio infettivo che viene affrontato facendo assumere al paziente una terapia antibiotica profilattica: a partire da 24 ore prima della biopsia e sino a qualche giorno dopo a seconda dei casi. Questa antibiotico-profilassi riduce notevolmente i rischi di infezione che la procedura potrebbe comportare. La biopsia prostatica eco-guidata è attualmente il gold standard e viene eseguita mediante approccio transrettale o transperineale. Le percentuali diagnostiche, in assenza di imaging preliminare con risonanza magnetica sono comparabili tra i due approcci; tuttavia alcune evidenze suggeriscono di utilizzare preferibilmente l’approccio transperineale per il minor rischio di complicanze infettive. In caso di biopsia tradizionale ecoguidata con prelievi sistematici (in genere almeno 12 prelievi + prelievi sulla lesione target), il medico introduce attraverso il retto una sonda ecografica, che qualora il prelievo sia effettuato per via transrettale, permette il passaggio di un ago sottile “tru-cut” per effettuare il prelievo. Invece nel caso in cui questo venga effettuato per via transperineale, l’ago “tru-cut”, previa infiltrazione di un anestetico locale, viene inserito nel perineo e sotto guida ecografica, fatto giungere a livello della prostata, per poter effettuare così i prelievi. I prelievi vengono distribuiti all’interno della ghiandola prostatica in maniera sequenziale seguendo uno schema a sestanti prostatici. Il numero di prelievi varia in genere da 12 a 14.
La RM multiparametrica (mp-RM) ricopre un ruolo fondamentale nell’individuazione del cancro della prostata in pazienti con sospetto clinico. Oggi , sempre più, si è cercato di utilizzare le informazioni che questa metodica ci offre , inserendo il suo utilizzo nella esecuzione di una biopsia prostatica. Possiamo infatti, oggi parlare di una Biopsia Cognitiva , di una Biopsia eseguita in corso di RMN (cosiddetta “in bore”) e di una biopsia eseguita con fusione di immagine (Biopsia Fusion) .
- La Biopsia Cognitiva eseguita sotto guida ecografica sulla base delle immagini RM (senza fusione digitale di immagini) risulta un approccio ragionevole, permettendo comunque di passare da una biopsia ‘alla cieca’ ad una biopsia mirata (Targeted Biopsy) ma che risulta comunque gravata da limiti in termini di accuratezza diagnostica .
La Biopsia “In-Bore” fra le modalità di esecuzione della Biopsia prostatica, è la più precisa. Rispetto alle altre modalità di biopsia, infatti, essa fa in modo che si possano testare le aree sospette direttamente durante la risonanza magnetica, acquisendo immagini in tempo reale e con un numero di prelievi inferiore. Obbligatoriamente la biopsia prostatica eseguita è una biopsia transrettale, eseguita con il paziente in posiziona prona.
- La Fusion Biopsy è una nuova tecnica, impiegata nella diagnosi di un sospetto tumore prostatico, questa tecnica combina le immagini della Risonanza Magnetica (RM) con quelle ecografiche. La biopsia prostatica fusion permette dunque di eseguire prelievi bioptici a carico della prostata seguendo le indicazioni fornite dalla risonanza magnetica multiparametrica (mpMRI), che acquisisce diversi parametri quali morfologia, vascolarizzazione, densità cellulare, metabolismo, e dunque rileva le lesioni sospette che l’ecografia non è in grado di individuare. Sovrapponendo le immagini della risonanza con quelle ecografiche è possibile indirizzare l’ago per la biopsia nelle zone con una reale potenzialità tumorale (lesione target). Nella biopsia prostatica mirata con tecnica fusion, la sonda ecografica viene introdotta attraverso il retto. La sincronizzazione delle immagini della RM multiparametrica con le immagini ecografiche consente di effettuare dei prelievi mirati della zona sospetta (2-3 prelievi sulla lesione target). Nella maggior parte dei casi viene successivamente eseguito un concomitante campionamento del resto della ghiandola prostatica mediante prelievi sempre sequenziali con tecnica a sestanti, in modo da ottenere una mappatura quanto più accurata possibile, in vista di un eventuale trattamento, nel caso in cui venga diagnosticato un tumore della prostata. Anche questa biopsia può essere eseguita per via transrettale o per via transperineale, quest’ultima sempre con anestesia locale. La biopsia fusion comporta dei notevoli benefici al paziente rispetto alla biopsia prostatica tradizionale: un minor numero di prelievi bioptici rispetto ad una biopsia ecoguidata tradizionale, con riduzione delle complicanze correlate all’esame bioptico della prostata (ematuria, infezioni delle vie urinarie, proctorragia), ma anche una notevole precisione nella diagnosi di tumori maggiormente aggressivi. Altri vantaggi della biopsia fusion confronta alla biopsia tradizionale sono: una minore necessità di dover eseguire più biopsie nel corso del tempo e una miglior valutazione nella gestione chirurgica del paziente affetto da neoplasia prostatica.
- Caratteristiche Anatomopatologiche
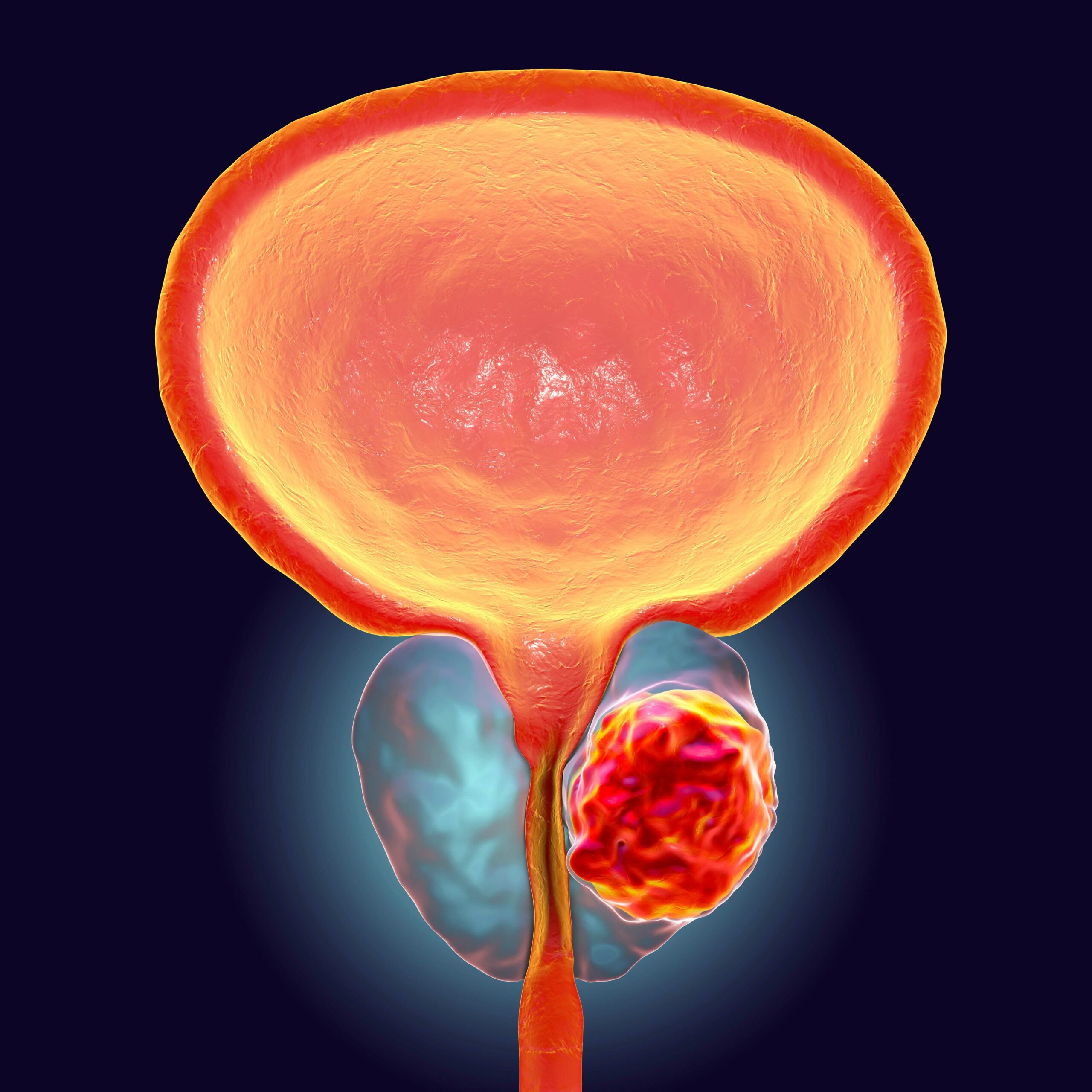
La neoplasia prostatica è in genere un adenocarcinoma. L’adenocarcinoma della prostata origina nella porzione periferica della ghiandola in oltre il 70% dei casi, ed è quindi spesso apprezzabile anche all’esplorazione rettale. Nella porzione antero-mediale transizionale dell’organo insorge il 20% delle neoplasie mentre la zona centrale è tipica della iperplasia prostatica ed è sede primaria solo del 5% delle neoplasie. I carcinomi prostatici sono per lo più multifocali ed eterogenei per grado e aspetto istologico. Il punteggio di Gleason rappresenta un dato patologico che viene individuato in modo soggettivo dal medico anatomo-patologo durante l’analisi al microscopio del tessuto prostatico ottenuti sia per biopsia che dopo chirurgia. Il patologo analizza le caratteristiche del tessuto tumorale e – in base a quanto l’aspetto di questo tessuto si allontana dall’aspetto normale – assegna un valore che può variare da 1 a 5, dove 1 è rappresentato da una forma tumorale con caratteristiche tissutali molto simili a quelli della ghiandola prostatica normale, mentre 5 è costituito da un tessuto tumorale completamente sovvertito e indifferenziato. Aspetti tissutali intermedi verranno ovviamente identificati con i numeri 2, 3 o 4. Per arrivare a calcolare il punteggio di Gleason occorre identificare le caratteristiche tissutali delle due aree tumorali maggiormente presenti e poi sommarne i valori. L’adenocarcinoma prostatico – infatti – si presenta spesso con aspetti diversi da una zona all’altra. Il patologo assegnerà prima il Gleason del tessuto tumorale più esteso e poi quello della zona tumorale ad estensione inferiore. Se per esempio il tessuto tumorale con estensione predominante ha un Gleason di 3 e l’area tumorale secondaria ha un Gleason di 4 il punteggio finale del tumore (o “Gleason score”) sarà 3 + 4 = 7. Quando il tumore è costituito da un unico tessuto omogeneo si raddoppia il valore del suo Gleason: se per esempio una neoplasia prostatica è formata unicamente da un tessuto tumorale con Gleason 3 il punteggio di Gleason di questo tumore sarà 3 + 3 = 6.
Lo score di Gleason, quindi, permette che permette di distinguere 5 gruppi diversi che esprimono una differente aggressività, dalla neoplasia meno aggressiva a quella più aggressiva:
- Gruppo di Grado 1 (ex score di Gleason 3+3=6 e inferiori),
- Gruppo di Grado 2 (ex score di Gleason 3+4=7),
- Gruppo di Grado 3 (ex score di Gleason 4+3=7),
- Gruppo di Grado 4 (ex score di Gleason 4+4=8 e 3+5=8),
- Gruppo di Grado 5 (ex score di Gleason 4+5=9, 5+4=9 e 5+5=10),
- Stadiazione clinica della malattia
Le informazioni riportate nel referto patologico sono estremamente importanti per definire le prospettive terapeutiche e la prognosi del paziente. La biopsia prostatica, pur avendo valore pressoché esclusivamente diagnostico, può anche contribuire alla stadiazione e quindi fornire informazioni importanti ai fini prognostici e della scelta del trattamento primario. Il trattamento del carcinoma della prostata si propone obiettivi diversi, a seconda dell’estensione anatomica e dell’aggressività della malattia, ma anche delle attese del paziente e della sua speranza di vita associata alla presenza di comorbidità che possono rappresentare un rischio di morte superiore a quello rappresentato dalla stessa neoplasia prostatica. Non bisogna, infatti, trascurare il fatto che una porzione non esigua (circa il 40%) dei pazienti cui viene diagnosticata una neoplasia prostatica è destinata a morire “con” e non “per” il proprio tumore e che questa percentuale comprende anche pazienti con malattia localmente avanzata o metastatica. La scelta terapeutica oggi si fonda su vari parametri inerenti la malattia e non solo sullo stadio clinico. Si preferisce pertanto fare riferimento a differenti categorie di rischio, in base a diverse caratteristiche oltre allo stadio clinico, come il PSA alla diagnosi, il Gleason score bioptico (Grade Group secondo ISUP 2014), il numero dei prelievi bioptici positivi sul totale di quelli campionati, che definiscono classi prognostiche omogenee.
- molto basso
malattia T1c; Gruppo di grado 1; PSA <10 ng/ml ; > 3 cores bioptici positivi con < 50% di malattia presente in un frustolo, PSA density < 0,15 ng/ml
- basso
T1-T2a; Gruppo di grado 1; PSA <10 ng/ml
- intermedio
T2b-T2c ; Gruppo di grado 2 o 3 ;PSA 10-20 ng/ml
- alto
T3a ; Gruppo di grado 4 ;Gruppo di grado 5 ; PSA >20 ng/mL
- molto alto
T3b – T4 ; Gleason primario pattern 5 ; 2 o 3 caratteristiche della classe di rischio “alto” ; >4 frustoli bioptici con Gruppo di grado 4 o 5
TRATTAMENTI
Il trattamento del carcinoma della prostata si propone obiettivi diversi, a seconda dell’estensione anatomica e dell’aggressività della malattia, ma anche della speranza di vita del paziente e della presenza di comorbilità che possono rappresentare un rischio di morte superiore a quello rappresentato dalla stessa neoplasia prostatica. Non bisogna, infatti, trascurare il fatto che una porzione non esigua (circa il 40%) dei pazienti cui viene diagnosticata una neoplasia prostatica è destinata a morire “con” e non “per” il proprio tumore e che questa percentuale comprende anche pazienti con malattia localmente avanzata o metastatica.
Per tale motivo, nei pazienti con breve speranza di vita (generalmente inferiore ai 10 anni), a causa dell’età avanzata o della presenza di comorbidità con più elevata letalità della stessa neoplasia prostatica, può essere indicata una politica di vigile attesa (watchful waiting). Allo stesso modo, pazienti affetti da una malattia a rischio molto basso-basso, pur in presenza di una buona aspettativa di vita, possono essere indirizzati verso una politica di sorveglianza attiva (active surveillance). Per quanto riguarda i pazienti con malattia apparentemente intraprostatica e a basso-molto basso rischio candidabili a terapie locoregionali con fini di radicalità, bisogna ricordare che ancora oggi la scelta terapeutica è prevalentemente basata su studi non controllati e che, pertanto, la scelta dei diversi approcci (sorveglianza attiva, prostatectomia radicale, radioterapia con fasci esterni, brachiterapia) deve basarsi sulle preferenze del paziente (considerando anche le diverse sequele legate ai singoli trattamenti), sullo skill professionale dell’equipe dei medici chiamata ad erogare il trattamento e sulle facilities di tipo tecnico disponibili (da applicarsi sia alle opzioni chirurgiche che a quelle radioterapiche). Queste considerazioni preliminari valgono anche per i pazienti a rischio intermedio-alto o molto alto che possono essere avviati a trattamenti con fini di radicalità, mancando anche in questo caso evidenze generate da studi randomizzati. Nonostante essi possano aspirare in misura più ridotta alla guarigione, è necessario che anche in questi pazienti, si debba comunque fare il possibile per perseguire un controllo adeguato della malattia sia a livello locale che a livello sistemico ciò che è possibile ottenere con l’impiego di trattamenti multimodali, in quanto, se adeguatamente trattati, questi pazienti possono comunque beneficiare di una sopravvivenza più lunga. Per riassumere:
- molto basso
malattia T1c; Gruppo di grado 1; PSA <10 ng/ml ; > 3 cores bioptici positivi con < 50% di malattia presente in un frustolo, PSA density < 0,15 ng/ml
- basso
T1-T2a; Gruppo di grado 1; PSA <10 ng/ml
Il trattamento di scelta è rappresentato o dal “watchful waiting” o dalla “active surveillance”.
- intermedio
T2b-T2c ; Gruppo di grado 2 o 3 ;PSA 10-20 ng/ml
- alto
T3a ; Gruppo di grado 4 ;Gruppo di grado 5 ; PSA >20 ng/mL
- molto alto
T3b – T4; Gleason primario pattern 5; 2 o 3 caratteristiche della classe di rischio “alto”; >4 frustoli bioptici con Gruppo di grado 4 o 5
Il trattamento di scelta per queste classi di pazienti prevede un trattamento attivo, ovvero:
- La Prostatectomia Radicale (PR). E’ una procedura che determina la rimozione chirurgica della prostata, delle ampolle deferenziali e delle vescicole seminali, comprensiva del tessuto circostante, sufficiente per ottenere margini chirurgici negativi. La continuità della via urinaria viene ripristinata con un’anastomosi vescico-uretrale. Ad oggi la linfadenectomia di stadiazione, se prevista, accompagna l’intervento di PR . L’obiettivo dichiarato della chirurgia nella malattia organo-confinata è l’eradicazione della patologia stessa e, quando possibile, la preservazione della continenza e della funzionalità erettile, elementi che restano però subordinati al fine oncologico.
Più che sull’età anagrafica è opportuno basarsi sull’aspettativa di vita del paziente, considerando che l’indicazione alla PR è ragionevole nei pazienti con almeno 10 anni di aspettativa di vita. Sarebbe, pertanto, opportuno avviare i pazienti più anziani ad una consulenza onco-geriatrica per valutare la loro aspettativa di vita e i potenziali benefici dell’intervento.
- La Radioterapia a Fasci Esterni (RT) è un’opzione di trattamento standard per gli uomini con cancro alla prostata localizzato e conferisce a lungo termine risultati sovrapponibili a quelli della prostatectomia radicale sul controllo di malattia. I miglioramenti tecnologici nella diagnostica per immagini e nella pianificazione e delivery dei trattamenti degli ultimi due decenni hanno portato ad una serie di progressi in ambito radioterapico. In particolare, questi includono l’uso di trattamenti ad intensità modulata e i trattamenti guidati dalle immagini (IGRT); questi progressi tecnologici hanno consentito in particolare l’implementazione di programmi di dose-escalation sulla prostata, migliorando così l’indice terapeutico.
Nei pazienti con malattia metastatica la palliazione rimane l’obiettivo più concretamente perseguibile, soprattutto se sintomatici. Per questi pazienti esistono attualmente varie opzioni di terapia ormonale e chemioterapia che, unitamente alle più recenti forme di terapia radiometabolica (alfa emittenti) e alle terapie bone-targeted, possono impattare significativamente sia sulla loro qualità che sulla loro speranza di vita. Peraltro, anche in questo caso, non mancano situazioni (progressione biochimica dopo fallimento della terapia ormonale di prima e/o seconda linea) in cui l’assenza di sintomi può autorizzare una condotta attendistica, dilazionando l’eventuale trattamento alla comparsa di sintomi, anche se i risultati di alcuni studi più recenti sembrerebbero in ogni modo avvantaggiare il trattamento immediato anche di questi pazienti.
Il 15-40% dei pazienti inizialmente avviati a chirurgia presenta a 5 anni una ricaduta biochimica e un terzo di essi svilupperà metastasi a distanza. Il tempo mediano alla comparsa delle lesioni secondarie dopo la risalita del PSA è di 8 anni. La radioterapia (RT) “di salvataggio” è un’opzione terapeutica in presenza di risalita (o persistenza) del PSA. Ovviamente questa indicazione si applica ai pazienti che non siano stati trattati precedentemente con RT adiuvante