Ipertrofia Prostatica
- GENERALITÀ
- DIAGNOSI
- Anamnesi
- Questionari
- Esami
- Analisi
- Diagnostica per immagini
- TRATTAMENTI
- Conservativo
- Farmacologico
- Fitoterapico
- Terapie Combinate
- Chirurgico
- Alternativi
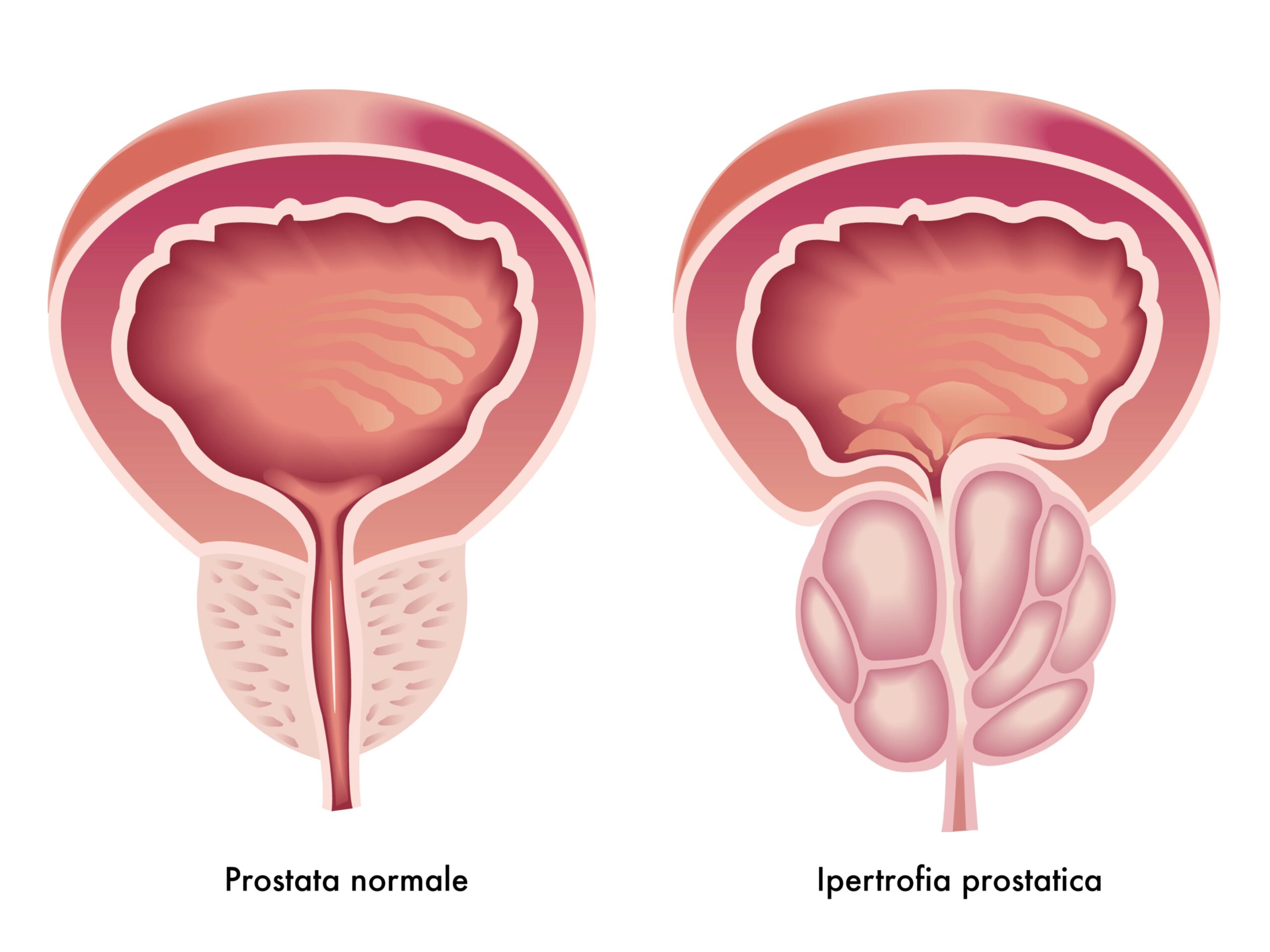
L’ipertrofia prostatica consiste in un ingrossamento della ghiandola (detta zona di transizione) ptostatica che impedisce lo svuotamento della vescica e causa disturbi urinari (LUTS). I sintomi delle basse vie urinarie (Lower Urinary Tract Symtoms-LUTS) possono essere suddivisi in tre gruppi: sintomi della fase di riempimento vescicale, sintomi della fase di svuotamento vescicale e sintomi della base post minzionale. I LUTS hanno una prevalenza elevata nella popolazione, causano notevoli disturbi e preoccupazione e hanno un impatto negativo sulla qualità di vita. Una crescente consapevolezza dei LUTS, in particolare dei sintomi della fase di riempimento vescicale, è necessaria al fine di discutere le diverse opzioni terapeutiche che potrebbero migliorare la qualità di vita dei pazienti. I LUTS sono fortemente associati all’invecchiamento, pertanto è probabile che il loro peso specifico ed i costi relativi alla loro gestione siano destinati ad aumentare con i futuri cambiamenti demografici. Tradizionalmente i LUTS sono stati associati a una condizione di ostruzione cervino-uretrale (Bladder Outlet Obstruction- BOO), spesso causata da un ingrossamento benigno della prostata (Benign Prostatic Enlargement-BPE) come risultato della condizione istologica di iperplasia prostatica benigna ( Benign Prostatic Hyperplasia-BPH) .
DIAGNOSI
Anamnesi
Un fattore imprescindibile è la valutazione della storia clinica del paziente. L’anamnesi ha lo scopo di identificare le cause potenziali dei LUTS e le comorbilità, comprese le malattie fisiche e neurologiche. Devono inoltre essere sempre considerate variabili quali la somministrazione di farmaci, lo stile di vita e fattori emotivi e psicologici. Per una valutazione più oggettiva e quantificativa dei LUTS, e come parte integrante dell’anamnesi urologica/chirurgica, è necessaria ottenere una autovalutazione dei sintomi sotto forma di questionari.
Questionari
Tutte le linee guida pubblicate per i LUTS maschili raccomandano l’uso di questionari validati per l’autovalutazione dei sintomi. Sono stati sviluppati diversi questionari che considerino anche le variazioni dei sintomi e che possono essere utilizzati per monitorare il trattamento terapeutico.
- International Prostate Symptom Score (IPSS)
L’IPSS è un questionario composto da 8 domande, sette delle quali investigano i sintomi legati alla minzione e l’ultima riguarda la qualità della vita percepita dal paziente. Il punteggio finale al questionario IPSS (rappresentato dalla somma dei punteggi delle singole domande) inserisce il paziente all’interno di uno dei quattro gruppi principali: “asintomatico” (0 punti), “leggermente sintomatico” (1-7 punti), “moderatamente sintomatico” (8-19 punti) e “gravemente sintomatico” (20-35 punti). Le limitazioni all’utilizzo di questo questionario includono la mancanza di valutazione dell’incontinenza, dei sintomi post-minzionali e dei disturbi causati da ciascun sintomo separatamente.
- Questionario Internazionale per la Valutazione di Incontinenza- The International Consultation on Incontinence Questionnaire (ICIQ-MLUTS)
ICIQ-MLUTS è un questionario validato, che deve essere compilato dal paziente . Contiene 13 domande con paragrafi specifici per la nicturia e la vescica iperattiva, ed è disponibile in diciassette lingue.
- Questionario Danese Sulla Valutazione dei Sintomi della Prostata: Danish Prostate Symptom Score (DAN-PSS)
Il DAN-PSS è utilizzato principalmente in Danimarca e Finlandia e fornisce un punteggio sui sintomi della prostata. ICIQ-MLUTS e DAN-PSS misurano il disturbo di ogni singolo LUTS.
Diari Minzionali e Tabelle Frequenza/Volume
La registrazione del volume di urine prodotte e l’orario di ciascuna minzione, da parte del paziente viene identificata come tabella Frequenza/Volume (FVC). L’aggiunta di ulteriori informazioni, come l’assunzione di liquidi (orario), la presenza di incontinenza o urgenza menzionale configurano quello che viene comunemente definito “Diario Minzionale”. Da un diario menzionale completato correttamente possono essere facilmente calcolati alcuni parametri come: la frequenza di svuotamento diurno e notturno, il volume delle singole minzioni, il volume totale svuotato e la frazione di urina prodotta durante la notte (poliuria-notturna index).
Esame obiettivo ed esame Digito-Rettale
Per cercare potenziali influenze sui LUTS deve essere eseguito un esame obiettivo completo, in particolare bisogna valutare la zona sovrapubica, i genitali esterni, il perineo e gli arti inferiori.
Deve essere esclusa la presenza di Ipospadia o Epispadia, stenosi mentale, fimosi e carcinoma del pene.
Esame Digito-Rettale e valutazione del Volume Prostatico
L’esplorazione Digito- rettale (DRE) è il modo più semplice per valutare il volume della prostata, anche se al momento la correlazione tra LUTS e il volume prostatico non è completamente definita. Scopo della procedura è la percezione tattile di ingrandimenti, irregolarità, nodosità ed aumenti di consistenza (durezza) della ghiandola, che consentano di distinguere una prostata sana, sede di un’ipertrofia prostatica, da una, sede di un carcinoma della prostata. La ghiandola è di dimensioni paragonabili a quella di una castagna, la consistenza è omogenea ed i limiti netti. Una ghiandola prostatica sana è in genere non dolente, è di dimensioni paragonabili a quella di una castagna, la consistenza è omogenea ed i limiti netti. E’ in genere apprezzabile il solco mediano, che permette di distinguere i due lobi. Non è dolente. La ghiandola, invece, sede di ipertrofia prostatica è di dimensioni variabili, da quelle di un mandarino a quelle di una arancia e la consistenza è disomogenea ed i limiti netti. E’ in genere poco apprezzabile il solco mediano, con uno dei due lobi prevalente rispetto all’altro. Non è dolente.
Purtroppo, però, l’esplorazione prostatica rettale digitale rimane un esame impreciso, anche se comunque utilissimo.
Analisi delle urine
L’analisi delle urine (stick delle urine o analisi del sedimento) deve essere inclusa nella valutazione prima- ria di qualsiasi paziente che presenti LUTS per identificare condizioni quali: infezioni del tratto urinario (UTI), microematuria e diabete mellito.
Antigene prostatico-specifico (PSA)
Il PSA o antigene prostatico specifico è una proteasi prodotta esclusivamente a livello della ghiandola prostatica. Dal punto di vista biochimico è una proteina, prodotta dalle vescicole seminali, che determina la coagulazione dello sperma. Il ruolo fisiologico del PSA è quindi correlato alla colliquazione del coagulo che si forma nel liquido seminale dopo l’eiaculazione.
Il PSA è utile della diagnosi perché ha mostrato di essere dotato sia un buon valore predittivo nel valutare il volume prostatico che nel predirre la crescita della ghiandola prostatica. Lo studio PLESS ha dimostrato che l’aumento del PSA può predirre sia i cambiamenti della sintomatologia, che della qualità della vita che degli indici uroflussometrici dei pazienti . In uno studio longitudinale su uomini trattati in maniera conservativa, il PSA risultava essere un predittore positivo della progressione clinica.
In grandi studi è stato evidenziato come il PSA sierico basale predice il rischio di ritenzione urinaria acuta (AUR) e la necessità di interventi chirurgici successivi. E’ stato recentemente dimostrato, infine, come il valore predittivo positivo del PSA nella diagnosi di BPO sia intorno al 68%.
Valutazione della Funzionalità Renale
La funzionalità renale può essere determinata misurando la cretinina sierica o calcolando velocità di filtrazione glomerulare (eGFR). L’idronefrosi, l’insufficienza renale o la ritenzione urinaria sono alterazioni della funzionalità renale frequenti nei pazienti con segni o stintomi di Ostruzione Prostatica.
Uno studio ha riportato che l’11% degli uomini con LUTS presentava insufficienza renale al momento della diagnosi.
Diagnostica per immagini
- Ecografia
L’immagine della prostata può essere eseguita tramite ecografia transaddominale ( sovrapubica), ecografia transrettale (TRUS), tomografia assiale computerizzata (TC) e risonanza magnetica (RM). Nella pratica quotidiana, gli studi più utilizzati sono quelli ecografici (sia sovrapubici che transrettali).
L’esame di scelta per lo studio ecografico della ghiandola prostatica è l’esame per via transrettale.
L’ecografia prostatica transrettale (TRUS) serve a verificare sia la “salute della prostata” in presenza di sintomi o disturbi sospetti come la difficoltà a urinare, la minzione frequente, la diminuzione del getto urinario o l’infertilità, sia a “sciogliere i dubbi” che derivino da un’esplorazione rettale eseguita in precedenza nel corso di una visita urologica, sia ad effettuare una diagnosi precoce di tumore alla prostata, sia a verificare il grado di risposta a una terapia medica con cui stiano curando disturbi minzionali (LUTS).
Per eseguire l’ecografia prostatica transrettale non è necessario che il paziente osservi alcun digiuno. È invece necessario che l’ampolla rettale sia il più possibile vuota. Non consigliamo comunque l’uso di un clistere nelle ore precedenti l’esame. Per la buona riuscita dell’ecografia, invece, è necessario che la vescica sia piena per cui al paziente viene consigliato, nell’ora che precede l’ispezione, di bere almeno un litro di acqua naturale non gassata, trattenendo le urine.
L’ecografia prostatica transrettale viene eseguita con il paziente sdraiato sul fianco destro e con le cosce flesse verso il petto, in posizione genupettorale (posizione di Sims).
Per prima cosa il medico con il proprio indice esegue un’esplorazione rettale per verificare che non vi siano impedimenti all’esecuzione dell’esame e per valutare direttamente le caratteristiche della ghiandola. Nel caso in cui non vi siano controindicazioni evidenti, inserisce una sonda ecografica lubrificata nell’ampolla rettale del paziente ed esegue l’esame utilizzando sia scansioni trasversali che longitudinali per determinare le caratteristiche volumetriche e morfologiche della ghiandola. L’esame non è né pericoloso né doloroso per il paziente. La durata dell’esame è in genere di 10 minuti. L’ecografia prostatica transrettale ha delle controindicazioni assolute (stenosi anali severe o incontinenza urinaria totale) o relative (emorroidi sanguinanti o ragadi anali).
L’ecografia transrettale permette di avere informazioni sia sulle dimensioni della ghiandola che sulle sue caratteristiche morfologiche. Valuta, infatti, i vari diametri della prostata: quello trasverso, quello antero-posteriore e quello longitudinale. Utilizzando questi diametri è possibile determinare il peso ed il volume complessivo della ghiandola prostatica (DTxDLxDAPx0,52 cioè Il PCAR). Il valore di riferimento per considerare una ghiandola di dimensioni normali è che questa non superi il peso di 25 gr. Nella porzione anteriore (zona transizionale) della prostata è spesso presente un nodulo di iperplasia prostatica (l’adenomioma). La morfologia del nodulo può essere varia (bilobato, trilobato con lobo medio, con terzo lobo) e condizionare in modo significativo la gravità dei sintomi presenti (LUTS). A livello della zona periferica, invece, devono essere ricercate l’eventuale presenza di aree ipoecogene (immagine di colore scuro), che, qualora presenti, devono far insospettire il clinico ed avviare un percorso di secondo livello. Devono sempre essere descritti sia l’aspetto del collo vescicale (iperplasico o no) che la morfologia delle vescicole seminali che le caratteristiche della capsula prostatica (integra o no).
L’ecografia sovrapubica vescicale permette di valutare contemporaneamente lo stato della vescica, l’eventuale PVR e due importati indicatori del gradi ostruzione determinato dall’ipertrofia prostatica, l’IPP score e il BWT. Grazie all’accesso sovrapubico, quindi possiano evidenziare la presenza all’interno della vescica di sospette neoformazioni vescicali, calcolosi vescicali, diverticoli vescicali e non ultime malformazioni congenite (ureteroceli o doppi distretti ureterali completi)
La misurazione ecografia della protrusione prostatica intravescicale (IPP), tramite scissione sovrapubica, valuta la distanza tra il punto più estremo del lobo mediano della prostata e il collo vescicale nel piano medio-sagittale con una vescica riempita di 150-250 ml; una profusione di I grado è di 0-4.9 mm, di II grado è di 5-10 mm e di III grado è maggiore di 10 mm. La protrusione prostatica intravescicale può anche essere correlata positivamente al volume prostatico, all’iperattività vescicale, alla compliance della vescica, la pressione del detrusore al flusso urinario massimale, all’indice di ostruzione cervico-uretrale e al PVR, e negativamente con il flusso massimo misurato durante esame uroflussimetrico (Qmax). L’IPP score si correla bene nei test urodinamici con l’ostruzione cervino-uretrale (presenza e gravità), con un valore predittivo positivo, del 94% e un valore predittivo negativo del 79%.
Per la valutazione dello spessore della parete della vescica (BWT), viene misurata la distanza tra la tonaca muscolare e quella avventizia. Per la valutazione dello spessore detrusoriale (DWT), si prende in considerazione solo lo spessore del muscolo detrusore inserito tra la mucosa e l’avventizia. Un valore soglia di 5 mm, calcolato sulla parete anteriore della vescica, con un riempimento di quest’ultima di 150 ml, può differenziare pazienti con o senza BOO. Lo spessore della parete detrusore, calcolato sulla parete anteriore della vescica con un riempimento vescicale superiore a 250 ml (valore soglia per BOO >2 mm) ha un valore predittivo positivo del 94 % e una specificità del 95%, raggiungendo un accordo dell’89% con l’esame uro- dinamico. Valori di soglia di 2.0, 2.5 o 2.9mm per DWT in pazienti con LUTS sono in grado di identificare rispettivamente l’81% e il 100 % dei pazienti con BOO. Tutti gli studi hanno rilevato che le misurazioni BWT o DWT hanno una maggiore accuratezza diagnostica per l’identificazione di una BOO rispetto alla Qmax o al flusso medio (Qave) ottenuti durante la uroflussometria, delle misurazioni del PVR, del volume della prostata o delle gravità dei sintomi.
L’ecografia renale permette di valutare la condizione dei reni, evidenziando quando presenti condizioni di dilatazione della via escretrice uni o bilaterale (ureteroidronefrosi), eventuale presenza di calcolosi o di sospette neoformazioni.
Uroflussometria
La valutazione del flusso urinario è un test urodinamico non invasivo ampiamente utilizzato. I parametri chiave analizzati nell’uroflussometria sono il Qmax (velocità massima di flusso urinario) e la morfologia della curva minzionale. Questo test andrebbe eseguito con un volume vescicale maggiore di 150 ml. Un basso Qmax pò presentarsi come conseguenza di ostruzione vescicale, di ipocontrattilita detrusoriale, o di una vescica con scarso riempimento. L’esame uroflussometrico è considerato limitato, non potendo discriminare tra le diverse possibili cause alla base dei suoi risultati. L’uroflussometria può essere utilizzata per monitorare i risultati del trattamento [84] e correlare i sintomi con risultati oggettivi.
Valutazione del Residuo Post Minzionale
Il residuo Post-minzionale (PVR), che deve sempre essere eseguito sia dopo diagnostica per immagini (ecografie) che dopo esame uroflussimetrico, può essere misurato mediante ecografia sovrapubica. La presenza di un elevato rischio post-minzionale non è necessariamente associata all’ostruzione vescicale, dal momento che questo può essere sia una conseguenza dell’ostruzione sia una conseguenza della scarsa contrattilità detrusoriale. Utilizzando una soglia di PVR di 50 ml, l’accuratezza diagnostica della misurazione PVR ha un valore predittivo positivo del 63% e un valore predittivo negativo del 52% nella previsione di ostruzione vescicale. Un residuo voluminoso non è di per sé una controindicazione alla vigile attesa (WW) o alla terapia medica, sebbene questo possa indicare una scarsa risposta al trattamento. Il monitoraggio delle variazioni del PVR nel tempo può consentire l’identificazione di pazienti a rischio di ritenzione acuta urinaria.
Esame Urodinamico
L’obiettivo principale dell’urodinamica, esame di secondo livello, è esplorare i meccanismi funzionali dei LUTS, identificare i fattori di rischio per eventuali complicanze e fornire informazioni quanto più dettagliate possibili per decidere il trattamento più opportuno.
Uretrocistoscopia
I pazienti con pregressi episodi di ematuria micro o macroscopica, stenosi uretrale o carcinoma della vescica, che si presentano con LUTS, devono essere sottoposti a uretrocistoscopia per una migliore valutazione diagnostica.
TRATTAMENTI
Trattamento conservativo
- Vigile attesa (WW)
Molti uomini affetti da LUTS non si lamentano dei loro sintomi a tal punto da richiedere un trattamento farmacologico o un intervento chirurgico. Pertanto, tutti gli uomini che presentano LUTS dovrebbero essere attentamente valutati prima di considerare un trattamento, al fine di stabilire la severità dei sintomi e distinguere coloro i quali presentano LUTS non complicati (la maggior parte) da quelli che presentano LUTS complicati. La strategia di vigile attesa rappresenta, quindi, una valida opzione per molti pazienti con LUTS non severi dal momento che pochi di loro andranno incontro a progressione verso una ritenzione urinaria acuta e svilupperanno delle complicanze come calcoli vescicali o insufficienza renale, mentre altri potranno rimanere stabili per anni.
Questo tipo di gestione deve includere i seguenti aspetti:
- Riduzione dell’introito di liquidi in determinati periodi per ridurre la frequenza urinaria quando è più inconveniente come, per esempio, durante la notte o quando si esce;
- Evitare o ridurre l’introito di caffeina o di alcolici che possono avere un effetto diuretico o irritante e aumentare l’eliminazione di liquidi, determinando un aumento della frequenza minzionale, dell’urgenza e della nicturia;
- Uso di tecniche di rilassamento e di doppia minzione;
- Uso di tecniche come la spremitura dell’uretra (“uretral milking”) per prevenire lo sgocciolamento post minzionale;
- Rieducazione vescicale che incoraggia gli uomini a resistere quando hanno l’urgenza minzionale al fine di aumentare la capacità della vescica e il tempo tra le minzioni;
- Trattamento della costipazione.
Trattamento farmacologico
- Antagonisti dei recettori α1 adrenergici (α1-litici)
I farmaci α1 bloccanti sono spesso considerati di prima linea nel trattamento farmacologico dei LUTS maschili a causa della rapidità di azione, buona efficacia e bassa incidenza e severità di effetti collaterali.
Meccanismo d’azione: I farmaci antagonisti dei recettori α1 adrenergici hanno lo scopo di inibire l’effetto della noradrenalina endogena sulle cellule muscolari lisce prostatiche riducendo il tono della muscolatura liscia prostatica e l’ostruzione cervico-uretrale (bladder outlet obstruction, BOO). I farmaci α1 litici attualmente disponibili in commercio sono i seguenti: alfuzosina cloridrato (alfuzosina), doxazosina mesilato (doxazosina), silodosina, tamsulosina cloridrato (tamsulosina), terazosina cloridrato (terazosina) e naftopidil. Esistono diverse formulazioni di questi farmaci e, sebbene le diverse formulazioni determinino diversi profili di farmacocinetica e tollerabilità, il loro impatto clinico complessivo è modesto.
Efficacia: Tutti gli alfa-litici hanno una simile efficacia a dosi appropriate. I loro effetti si sviluppano pienamente in alcune settimane, sebbene la loro efficacia rispetto al placebo sia evidente già dopo alcune ore o giorni. Studi controllati hanno dimostrato come i farmaci α1 litici tipicamente riducono l’IPSS di circa il 30-40% e aumentano il Qmax di circa il 20-25%. Gli antagonisti dei recettori α1 adrenergici riducono sia i LUTS della fase di riempimento vescicale che quelli di svuotamento. L’efficacia degli alfa-litici è simile in tutti i gruppi di età.
Sicurezza e tollerabilità: La distribuzione tissutale, la selettività per alcuni sottotipi recettoriali e il profilo farmacocinetico di alcune formulazioni può contribuire a delineare il profilo di tollerabilità dei singoli farmaci. Gli effetti avversi più frequenti dei farmaci α1 litici sono l’astenia, le vertigini e l’ipotensione ortostatica. Gli effetti di vasodilatazione sono più pronunciati per la doxazosina e la terazosina, mentre sono meno comuni con l’alfuzosina e la tamsulosina .
Un evento avverso oculare che prende il nome di “intra-operative floppy iris syndrome” (IFIS) o sindrome intraoperatoria dell’iride a bandiera è stata descritta nel 2005 durante interventi di chirurgia per la cataratta. Una metanalisi sull’IFIS dopo assunzione di alfuzosina, doxazosina, tamsulosina e terazosina ha dimostrato un rischio aumentato per tutti gli α1 litici.
Una revisione sistematica ha evidenziato come l’uso degli α1 litici non ha effetti negativi sulla libido, ha un modesto effetto di beneficio sulla funzione erettile ma talora può determinare un’eiaculazione anomala. Inizialmente si riteneva che l’eiaculazione anomala fosse di tipo retrogrado ma studi più recenti hanno dimostrato che in realtà è dovuta a una riduzione sino all’assenza del liquido seminale durante l’eiaculazione.
- Inibitori della 5α reduttasi
Il trattamento con 5-ARI dovrebbe essere considerato nei pazienti con LUTS mo- derati/severi e dimensioni prostatiche > 40 ml e/o valori di PSA > 1.4-1.6 ng/ml. Gli inibitori della 5α reduttasi possono prevenire la progressione di malattia con riferimento alla RUA ed alla necessità di terapia chirurgica. A causa dell’esordio lento della loro azione, i 5-ARI sono adatti soltanto alle terapie di lunga durata (anni). L’effetto sui valori sierici di PSA deve essere considerato in relazione allo screening del tipo 1 che la 5α reduttasi di tipo 2 con potenza simile.
Esistono due isoforme di enzima 5α reduttasi:
5α reduttasi tipo 1, con predominante espressione e attività nei tessuti extraprostatici, come la cute e il fegato.
5α reduttasi di tipo 2, con predominante espressione ed attività a livello prostatico.
Due inibitori della 5α reduttasi (5-ARI) sono disponibili per l’impiego clinico: dutasteride e finasteride. La finasteride inibisce solo la 5α reduttasi di tipo 2, mentre la dutasteride inibisce sia la 5α reduttasi Gli inibitori della 5α reduttasi agiscono inducendo l’apoptosi delle cellule epiteliali prostatiche, determinando una riduzione delle dimensioni prostatiche di circa il 18-28% e una riduzione dei livelli circolanti di PSA di circa il 50% dopo 6-12 mesi di trattamento. La riduzione media dei volumi prostatici e dei valori di PSA può essere ancora più pronunciata per trattamenti più prolungati.
Efficacia: Gli effetti clinici rispetto al placebo sono evidenti dopo un trattamento della durata di almeno 6 mesi. Dopo 2-4 anni di trattamento, i 5-ARI migliorano l’IPSS di circa il 15-30%, riducono il volume pro- statico di circa il 18-28% e aumentano il Qmax di 1.5-2.0 ml/s nei pazienti con LUTS e ipertrofia prostatica. La riduzione dei sintomi è correlata alle dimensioni prostatiche iniziali.
La finasteride, infatti, potrebbe non essere più efficace del placebo nei pazienti con prostate < 40 ml, a differenza della dutasteride che sembra ridurre l’IPSS, il volume prostatico ed il rischio di ritenzione urinaria acuta e aumentare il Qmax anche nei pazienti con volumi prostatici iniziali compresi tra 30 e 40 ml.
I 5-ARI ma non i farmaci α1 bloccanti si sono dimostrati efficaci nel ridurre il rischio di ritenzione urina- ria acuta a lungo termine (> 1 anno) e il ricorso alla terapia chirurgica
Sicurezza e tollerabilità: Gli effetti collaterali più importanti dei 5-ARI sono associati alla funzione sessuale e includono calo della libido, disfunzione erettile (DE) e, meno frequentemente, disturbi dell’eiaculazione come l’eiaculazione retrograda, l’aneiaculazione o un ridotto volume dell’eiaculato. La ginecomastia con dolorabilità delle mammelle o dei capezzoli è stata riportata solo nell’1-2% dei pazienti.
Meccanismo d’azione: Gli effetti degli ormoni androgeni sulla prostata sono mediati dal diidrotestosterone (DHT), che è convertito dal testosterone a opera dell’enzima 5α reduttasi (154).
di tumore prostatico
- Estratti di piante – fitoterapia
La Serenoa Repens estratta con esano è l’unico fitofarmaco raccomandato per un utilizzo consolidato dalle linee guida internazionali
Potenziale meccanismo d’azione: I preparati a base di piante sono costituiti da radici, semi, pollini, bacche e frutti. Esistono preparati a base di singole piante (mono-preparati) e preparazioni che combinano due o più estratti di piante in un’unica compressa (preparati combinati).
I possibili componenti rilevanti includono i fitosteroli, il ß-sitosterolo, gli acidi grassi e le lectine . Studi in vitro hanno dimostrato che gli estratti di piante possono avere una attività anti-infiammatoria, anti-androgena ed effetti estrogenici, ridurre i livelli di sexual hormone binding globulin, inibire l’aromatasi, la lipoossigenasi, i fattori di crescita che stimolano la proliferazione delle cellule prostatiche, i recettori α-ad- renergici, le 5 α-reduttasi, i recettori muscarinici, i recettori diidropiridinici e vanilloidi e neutralizzare i radicali liberi.
Questi effetti non sono però stati confermati da studi in vivo ed il preciso meccanismo d’azione dei fitoterapici rimane ad oggi da chiarire.
Efficacia: Gli estratti della stessa pianta prodotti da diverse compagnie non necessariamente hanno gli stessi effetti clinici o biologici, pertanto gli effetti di un marchio non possono essere estrapolati da altri. Inoltre, lotti dello stesso produttore possono contenere differenti concentrazioni delle sostanze attive. Una recente revisione sulle tecniche di estrazione ed il loro impatto sulla composizione e sulla attività biologica della Serenoa repens basata sui prodotti disponibili ha dimostrato che i risultati dei diversi trials devono essere confrontati rigorosamente in base alla stessa tecnica di estrazione validata e/o al contenuto di sostanze attive. Pertanto, le proprietà farmacocinetiche possono variare in maniera significativa.
- Inibitori della 5 fosfodiesterasi
Il tadalafil 5 mg in monosomministrazione giornaliera è stato ufficialmente autorizzato per il trattamento dei LUTS maschili nei pazienti con o senza disfunzione erettile. I pazienti che mostrano un maggior beneficio dall’impiego dei PDE5Is sono i pazienti più giovani, con BMI basso e con LUTS più severi. L’esperienza a lungo termine con tadalafil nei pazienti con LUTS è limitata .
Meccanismo d’azione: gli inibitori della 5 fosfodiesterasi (PDE5I) determinano un aumento intracellulare della guanosina ciclica monofosfato (cGMP), riducendo il tono della muscolatura liscia del detrusore, della prostata e dell’uretra. L’ossido nitrico e le fosfodiesterasi possono anche alterare dei riflessi a livello del midollo spinale e la neurotrasmissione a livello dell’uretra, della prostata o della vescica (199). Inoltre, la terapia cronica con PDE5I sembra aumentare la perfusione ematica e l’ossigenazione nel tratto urinario inferiore (200). In ultimo, i PDE5I possono ridurre l’infiammazione cronica a livello prostatico e vescicale.
Efficacia: Diversi trials clinici randomizzati hanno dimostrato che i PDE5I riducono l’IPSS, i sintomi della fase di riempimento e della fase di svuotamento vescicale e migliorano la qualità di vita dei pazienti.
Sicurezza e tollerabilità: gli effetti collaterali dei PDE5Is nei pazienti con LUTS comprendono l’arrossamento del volto, il reflusso gastroesofageo, la cefalea, la dispepsia, il mal di schiena e la congestione nasale. Il tasso di abbandono della terapia a causa degli effetti collaterali per il tadalafil è stato del 2.0% e non differiva per età, severità dei LUTS, livelli di testosterone o volume prostatico all’analisi complessiva dei dati.
I PDE5I sono controindicati nei pazienti che assumono nitrati, farmaci che determinano un’apertura dei canali del potassio come il nicorandil e gli α1-litici doxazosina e terazosina. Sono inoltre controindicati nei pazienti affetti da angina pectoris instabile, nei pazienti che hanno avuto un infarto del miocardio da meno di tre mesi o un ictus da meno di sei mesi, nei pazienti con insufficienza cardiaca (New York Heart Association > 2), nei pazienti affetti da ipotensione o ipertensione arteriosa scarsamente controllata, nei pazienti con insufficienza epatica o renale severa e nei pazienti con neuropatica ottica anteriore ischemica con improvvisa perdita della vista nota o riportata dopo precedente impiego dei PDE5Is.
- Agonisti Beta-3 adrenergici
Meccanismo di azione: i recettori Beta-3 adrenergici sono il tipo di recettori beta predominanti espressi nelle cellule muscolari lisce del detrusore e si pensa che la loro stimolazione induca il rilassamento della muscolatura liscia detrusoriale. La modalità d’azione dei farmaci beta-3 agonisti non è stato completamen- te chiarito (227).
Efficacia: il mirabegron 50 mg è stato il primo agonista beta-3 adrenergico disponibile approvato per l’impiego negli adulti con iperattività vescicale. Il mirabregon è stato studiato in pazienti di sesso maschile con vescica iperattiva, nel contesto di LUTS associati o meno ad ostruzione prostatica benigna (BPO), confermata all’esame urodinamico. Il mirabregon 25 mg (assunzione giornaliera) comporta un miglioramento della soddisfazione del paziente e dello score relativo alla qualità di vita, ma i sintomi valutati con score validati (IPSS e OAB-SS) migliorano soltanto nei pazienti non ostruiti.
Sicurezza e tollerabilità: I più comuni effetti collaterali associati alla terapia con mirabegron sono stati l’ipertensione arteriosa, le infezioni delle vie urinarie (IVU), la cefalea e le rinofaringiti. Il mirabegron è controindicato nei pazienti con ipertensione arteriosa severa non controllata (pressione sistolica > 180 mmHg o diastolica > 110mmHg, o entrambe). I valori di pressione arteriosa devono essere pertanto misurati prima di iniziare il trattamento e in seguito monitorati regolarmente durante il trattamento
Terapie combinate
- α1-litici + inibitori delle 5α-reduttasi
La terapia combinata determina un miglioramento maggiore dei LUTS e del Qmax ed è superiore nella prevenzione della progressione di malattia. Tuttavia, è associata anche ad una maggiore frequenza di effetti collaterali. Pertanto, dovrebbe essere prescritta nei pazienti con LUTS moderati/severi a rischio di progressione di malattia (volumi prostatici maggiori, PSA più elevato, età più avanzata, PVR maggiore, Qmax più basso, ecc.). La terapia combinata dovrebbe essere impiegata soltanto quando è previsto un trattamento a lungo termine (> 12 mesi) e i pazienti dovrebbero essere informati di questo.
Meccanismo d’azione: La terapia combinata consiste nella somministrazione di un farmaco α1-litico e di un inibitore delle 5α-reduttasi. L’α1-litico manifesta i suoi effetti clinici entro ore o giorni, mentre il 5-ARI necessita di alcuni mesi per evidenziare la sua piena efficacia clinica. La finasteride è stata valutata in studi clinici di associazione con l’alfuzosina, la terazosina o la doxazosina e la dutasteride con la tamsulosina.
Efficacia: Molti studi hanno indagato l’efficacia della terapia combinata rispetto alla terapia con soli α1-lit- ici, 5-ARI o placebo. Studi iniziali con follow-up a 6 e 12 mesi hanno dimostrato che gli α1-litici erano superiori alla finasteride nella riduzione dei sintomi mentre la terapia combinata con entrambi i farmaci non era superiore alla monoterapia con α1-litico.
I dati a lungo termine (4 anni) (studio MTOPS e studio CombAT) hanno dimostrato che la terapia combinata è superiore alla monoterapia per il miglioramento dei sintomi e del Qmax e superiore alla monoterapia con soli α-litici nel ridurre il rischio di AUR e di trattamento chirurgico.
Sicurezza e tollerabilità: Gli effetti collaterali di entrambe le classi di farmaci sono stati riportati nella terapia combinata. Gli effetti avversi osservati in corso di terapia combinata erano quelli tipici degli α1-litici e dei 5-ARI.
- α1-litici + antagonisti dei recettori muscarinici
La terapia combinata è più efficace nel ridurre l’urgenza, l’incontinenza urinaria da urgenza, la frequenza minzionale, la nicturia e l’IPSS rispetto agli α1-litici o al placebo e migliora la qualità di vita. Il miglioramento dei sintomi è più evidente indipendentemente dai valori di PSA, mentre la tolterodina da sola è associata a un miglioramento dei sintomi prevalentemente nei pazienti con valori di PSA < 1.3 ng/ ml.
Meccanismo d’azione: La terapia combinata consiste nella somministrazione di un α1-litico insieme a un antimuscarinico allo scopo di antagonizzare sia i recettori α1-adrenergici che i recettori muscarinici. Le possibili associazioni non sono state ancora tutte testate in studi clinici.
Efficacia: Numerosi studi clinici randomizzati e studi prospettici hanno valutato la terapia combinata, della durata di 4-12 settimane, sia come trattamento iniziale di pazienti con vescica iperattiva e presunta ostruzione prostatica benigna, sia come terapia sequenziale per il trattamento di sintomi da riempimento persistenti in corso di terapia con α1-litici
Sicurezza e tollerabilità: Gli effetti collaterali di entrambe le classi di farmaci sono stati riportati in corso di terapia combinata con α1-litici e antimuscarinici. L’effetto collaterale più comune è la xerostomia. L’aumento dell’incidenza di alcuni effetti collaterali come la xerostomia e l’aneiaculazione può non essere spiegato semplicemente sommando l’incidenza con i due farmaci assunti separatamente. Può essere riscontrato un aumento del PVR, generalmente non clinicamente significativo, e il rischio di AUR è complessivamente basso.
TRATTAMENTO CHIRURGICO
Il trattamento chirurgico è di solito richiesto quando i pazienti hanno avuto episodi frequenti di ritenzione urinaria, incontinenza da rigurgito, infezioni urinarie ricorrenti, calcoli vescicali o diverticoli, ematuria macroscopica causata da Iperplasia prostatica o allargamento prostatico resistente al trattamento oppure dilatazione delle alte vie escretrici causata da ostruzione prostatica con o senza insufficienza renale (indicazioni assolute all’intervento, necessarie per la chirurgia).
Inoltre, la chirurgia è necessaria quando i pazienti non hanno ottenuti benefici adeguati nei LUTS o nel PVR con i trattamenti conservativi o farmacologici (indicazioni relative all’intervento).
La scelta della tecnica chirurgica dipende dal volume prostatico, dalle comorbidità del paziente, dal tipo di anestesia disponibile, dalle preferenze del paziente, dalla volontà ad accettare gli effetti collaterali dati dall’intervento chirurgico, dalla disponibilità dello strumentario e dall’esperienza del chirurgo con le varie tecniche
Approccio endoscopico transuretrale
Asportazione dell’adenoma prostatico con bisturi a sorgente di energia elettrica
- Resezione endoscopica adenoma prostata (cTURP) con
L’operazione standard in endoscopia per il trattamento della ipertrofia prostatica è classificata come resezione endoscopica della prostata con la sigla T.U.R.P. (Trans Urethral Resection of Prostate). La TURP come la conosciamo oggi, è stata sviluppata negli Stati Uniti tra il 1920 e il 1930. Con il passare degli anni e il miglioramento dei mezzi a disposizione, ha guadagnato popolarità in tutto il mondo ed è ancora oggi considerata il gold standard per il trattamento chirurgico di IPB. Durante la TURP, il tessuto prostatico iperplastico della zona di transizione viene rimosso endoscopicamente utilizzando un resettore con ansa di taglio ad energia elettrica, che permette l’ablazione del tessuto in piccole sezioni (chips) che vengono poi rimosse dalla vescica al termine della chirurgia. Nella TURP si utilizza uno strumento endoscopico chiamato resettore, che viene introdotto nel canale uretrale. Grazie ad un sistema ottico presente sull’apparecchio, il medico è in grado di osservare direttamente tramite un oculare, o tramite una telecamera posta all’estremità dell’oculare, l’interno dell’uretra, e di individuare i lobi prostatici che occludono il canale uretrale. Il resettore è provvisto di un’ansa fissata su un manipolo, la quale permette di eseguire asportazione di lembi prostatici che in seguito vengono estratti dalla vescica (su tali reperti è possibile eseguire esami istologici).La corrente elettrica è un’altra variabile di fondamentale importanza; dalla qualità e precisione di erogazione della energia dipende la precisione ed efficacia nel taglio del tessuto e la coagulazione di eventuali vasi sanguinanti. L’eventuale dispersione nei tessuti del paziente può facilitare l’insorgenza di stenosi uretrali o interferire con il ritmo cardiaco, in particolare in pazienti portatori di “pacemaker”. La Resezione Transuretrale avviene in ambiente liquido ed il liquido utilizzato ha una importanza fondamentale. Nell’arco di 60-90 minuti (che rappresenta il tempo medio di una TURP) possono essere utilizzate svariate decine di litri di soluzione di irrigazione, parte del quale viene inevitabilmente riassorbito dal paziente, con conseguenze anche molto gravi fino al decesso del paziente stesso. Questo configura la cosiddetta “Sindrome da TURP” o “TUR syndrome”, una sindrome da emodiluizione con alterazione dei principali elettroliti del siero ed alterazioni cardiocircolatorie anche letali. l’introduzione di generatori di corrente elettrica bipolare ha svolto un ruolo determinante; ha infatti consentito l’abbandono delle soluzioni colloidali non elettrolitiche (indispensabili a prevenire la dispersione della corrente monopolare), in favore dell’utilizzo di soluzione fisiologica enormemente meno pericolosa in caso di riassorbimento massivo. Non a caso la Resezione Transuretrale con corrente bipolare è divenuta la procedura chirurgica di riferimento nel trattamento della ipertrofia prostatica.
- Complicanze intraoperatorie
Emorragia, talvolta di entità tale da richiedere trasfusioni di sangue, emocomponenti o emoderivati (nell’1% dei casi);
Sindrome da riassorbimento del liquido di irrigazione o TUR-syndrome (2% dei casi) con sintomi quali nausea, vomito e ipertensione arteriosa;
- Complicanze postoperatorie
Ritenzione urinaria (6.5% dei casi), può presentarsi alla rimozione del catetere e richiede il riposizionamento dello stesso per un altro breve periodo
Infezione urinaria (15.5% dei casi);
Orchiepididimite (1.1% dei casi), infiammazione di uno o entrambi i testicoli;
Complicanze generali peri-operatorie che includono broncopolmonite, trombosi venosa profonda, embolia polmonare, osteite del pube, infezione della ferita chirurgica;
- Complicanze a distanza
Incontinenza urinaria (2.2% dei casi), che può essere dovuta a deficit sfinterico (incontinenza da sforzo) oppure a iperattività della vescica;
Sclerosi del collo vescicale (1.7% dei casi);
Stenosi dell’uretra (3.1% dei casi);
Deficit delle erezioni (10-15% dei casi);
Ipertrofia prostatica recidiva: a causa della possibile ricrescita di tessuto prostatico la probabilità di dover ricorrere ad una revisione della loggia prostatica entro 8 anni dopo questo intervento è pari al 12-15%
Effetti collaterali: Eiaculazione retrograda, presente nel 70 % dei casi è responsabile di sterilità; è correlata all’abbassamento della pressione a livello del collo vescicale e quindi a monte dello sbocco dei dotti eiaculatori determinando una più facile risalita del liquido seminale in vescica.
La corrente abitualmente utilizzata nella Resezione Transuretrale è una corrente monopolare, che richiede l’applicazione di un elettrodo a placca come polo negativo, di solito alla coscia del paziente.
TURP con energia Monopolare
Meccanismo d’azione: lo scopo della resezione transuretrale monopolare della prostata (M-TURP) è quello di rimuovere tessuto dalla zona di transizione della prostata. Lo scopo dell’incisione transuretrale della prostata è quello di incidere il collo vescicale senza rimuovere tessuto. Questo secondo approccio è utiliz- zato in casi selezionati, specialmente quando il volume prostatico è inferiore a 30 ml, in assenza di terzo lobo.
Efficacia: La TURP aumenta il Qmax medio (+162%), diminuisce l’IPSS (-70%), il punteggio QoL (-69%) ed il PVR (-77%) (278). L’intervento di TURP offre risultati durevoli come dimostrato da studi con un follow-up di 8-22 anni. Non ci sono dati simili sulla durata di qualsiasi altro trattamento chi- rurgico per l’ostruzione prostatica benigna. I dati presenti in letteraturamostrano che il tasso globale di re-intervento (re-TURP, uretrotomia e incisione del collo vescicale) è rimasto immutato durante la scorsa decade (0.9%, 3.7%, 9.5% e 12.7% a 3 mesi, 1 anno, 5 anni e 8 anni rispettivamente) e che la corrispondente incidenza di re-TURP è stata di 0.8%, 2.4%, 6.1% e 8.3%.
Tollerabilità e sicurezza: la mortalità e la morbilità perioperatorie si sono ridotte nel tempo, ma soprattutto quest’ultima rimane ancora considerevole (rispettivamente 0.1% e 11.1%). I dati di uno studio austriaco comprendente due coorti di pazienti per un totale di 41059 uomini sottoposti a TURP ha mostrato una riduzione del tasso di mortalità del 20% (0.1% a 30 giorni e 0.5% a 90 giorni). Il rischio di TUR syndrome è sceso al di sotto dell’1.1%. Risultati analoghi di complicanze post TURP sono stati riportati da un’analisi di studi clinici contemporanei utilizzando la TURP come comparatore: sanguinamento che richiede trasfusione 2% (0-9%), TUR syndrome 0.8% (0-5%), AUR 4.5% (0-13.3%), tamponamento vescicale da coaguli 4.9% (0-39%) e IVU 4.1% (0-22%). Le complicanze a lungo termine comprendono incontinenza urinaria, ritenzione urinaria e IVU, contrattura del collo vescicale (BNC), stenosi uretrale, eiaculazione retrograda e deficit erettile (DE).
TURP con energia Bipolare
Negli ultimi anni sono stati sviluppati dei generatori di corrente bipolare unitamente a degli endoscopi che contengano entrambi i poli elettrici con i seguenti principali vantaggi: assenza di dispersione della corrente, che non attraversa più il corpo del paziente; maggiore precisione ed efficacia in particolare nella funzione di coagulazione dei vasi sanguinanti; utilizzo di liquidi di irrigazione meno pericolosi possibilità di prolungare la procedura nel tempo con maggiore sicurezza. La B-TURP rappresenta una valida alternativa alla M-TURP in pazienti con LUTS moderati/severi secondari a ostruzione prostatica benigna, con efficacia simile ma con minore morbilità peri-operatoria. I vantaggi della B-TURP sono stati documentati in diversi RCT con follow-up di media dura- ta. I risultati a lungo termine (fino a cinque anni) per B-TURP hanno dimostrato che la sicurezza e l’efficacia sono paragonabili a quelle della M-TURP. La scelta della B-TURP dev’essere basata sulla disponibilità delle attrezzature, sull’esperienza del chirurgo e sulle preferenze del paziente.
Meccanismo d’azione: il vantaggio della TURP bipolare (B-TURP) rispetto a quella monopolare (M-TURP) è quello di poter utilizzare durante la resezione la soluzione fisiologica. A differenza della M-TURP, durante la B-TURP, l’energia non viaggia attraverso il corpo per raggiungere una piastra cutanea. Infatti l’energia generata da un circuito bipolare è confinata tra un polo attivo (ansa del resettore) e un polo passivo situato sulla punta del resettore (“veri” sistemi bipolari) o sulla camicia (sistemi “quasi” bipolari). La rimozione del tessuto prostatico avviene con le stesse modalità della M-TURP. I vari dispositivi bipolari disponibili differiscono nel modo in cui viene erogato il flusso di corrente.
Tollerabilità e sicurezza: i risultati complessivi preliminari hanno concluso che non esistono differenze nel breve periodo in termini di tasso di stenosi uretrale e BNC, ma la B-TURP è risultata migliore dal punto di vista della sicurezza peri-operatoria (riducendo il rischio di TUR syndrome, tamponamento vescicale da coaguli, necessità di trasfusioni e migliorando i tempi di cistoclisi, cateterizzazione e ospedalizzazione
Efficacia: la TURP bipolare è l’alternativa alla M-TURP maggiormente diffusa e studiata. I primi risultati complessivi hanno evidenziato che non esistono differenze clinicamente rilevanti sull’efficacia a breve termine (in termini di score IPSS, QoL e Qmax). Successive metanalisi hanno supportato queste conclusioni, anche se la qualità degli studi era generalmente scarsa. I dati di studi randomizzati a medio-lungo follow-up (fino a 60 mesi) non hanno mostrato differenze nei parametri di efficacia
Enucleazione adenoma prostata (TUEP) con bisturi elettrico
L’ Enucleazione adenoma prostata (TUEP) con bisturi elettrico è innovativa tecnica chirurgica endoscopica mininvasiva, che consiste nella enucleazione prostatica bipolare che viene eseguita quando devono essere trattate delle prostate di dimensioni notevolmente aumentate non trattabili con l’intervento classico endoscopico (TURP).
La tecnica TUEP è oggi eseguita in Italia in pochi centri urologici di eccellenza.
L’intervento consiste con una tecnica mini-invasiva, transuretrale, di produrre, una volta incisa l’uretra prostatica, un progressivo scollamento anatomico dell’adenoma prostatico dalla sua capsula chirurgica, . Questa manovra può essere eseguita con tecniche diverse, B-TUEP o BipolEP, ottenendo comunque un risultato identico, cioè quello di far cadere l’adenoma nel lume uretrale e da qui in vescica.
A seconda della tecnica impiegata, si procede alla progressiva frantumazione del tessuto adenomatoso che potrà essere effettuata o con l’utilizzo di un ansa bipolare (BTUEP) o di un morcellatore , dove il tessuto viene triturato verrà poi aspirato all’esterno, con la possibilità di eseguire, sempre, in entrambe le procedure, un esame istologico dei frammenti asportati.
Questa procedura viene utilizzata con una anestesia loco regionale e l’indicazione principe è la voluminosa ipertrofia della prostata che altrimenti verrebbe operata chirurgicamente a cielo aperto con il taglio.
Questa tecnica bipolare risulta meno costosa della tecnica di enucleazione dell’adenoma attraverso il laser, prevede un minor numero di giorni di degenza e un minor rischio di sanguinamento intra e post operatorio, ridotto tempo operatorio e minore energia erogata rispetto alle sovrapponibili metodiche laser (HolEP/GreenlEP), questo comporta una minore percentuale di sintomatologia minzionale irritativa rispetto alle metodiche laser.
Asportazione dell’adenoma prostatico con bisturi a sorgente di energia laser
Il concetto di laser venne elaborato da Einstein nel 1917: consisteva nell’idea di poter stimolare l’emissione di radiazioni, bombardano di energia un materiale. Einstein sosteneva che “Non possiamo risolvere i problemi con lo stesso tipo di pensiero che abbiamo usato quando li abbiamo creati”. Grazie a questo suo modo di affrontare i problemi descrisse una tecnologia che solo molti anni dopo vedette la sua effettiva realizzazione.
Infatti, si dovette aspettare il 1954 perché il fisico americano Charles Townes sviluppasse il primo antenato del laser, il Maser, utilizzando dapprima le microonde, poi gli infrarossi ed infine la luce visibile. Per questa sue applicazioni fu insignito del premio Nobel nel 1964.
Il primo vero laser, invece, fu costruito e brevettato il 16 maggio 1960, dal fisico e ingegnere americano Theodor Harold Maiman.
L’utilizzo dei laser in Urologia risale già alla seconda metà degli anni 60 quanto si tentò la frammentazione endoscopica di calcoli vescicali mediante l’energia di un laser a rubino. Un laser è un dispositivo che emette un fascio di luce coerente e collimata sfruttando il fenomeno dell’emissione stimolata.
La storia della chirurgia prostatica con il laser
Negli Anni ’90 si assistette alle prime applicazioni del laser nel trattamento dell’ipertrofia prostatica benigna.
- VLAP (Visual Laser Ablation of the Prostate)
Uno dei primi laser ad essere utilizzato nel trattamento della BPH è stato il Nd:YAG (1992, Costello et al. ), per realizzare la procedura VLAP (Visual Laser Ablation of the Prostate).
Questa tecnica prevedeva l’uso, in modalità non-contatto, di una fibra laser ortogonale che veniva inserita in un cistoscopio. La potenza usata era di 60W in continua e l’effetto di vaporizzazione veniva controllato visivamente. Con questo tipo d’intervento si ottenevano risultati soddisfacenti solo nel trattamento di prostate di piccole dimensioni a causa della scarsa efficienza di vaporizzazione del laser Nd:YAG. Il laser a neodimio opera infatti ad una lunghezza d’onda di 1064nm che, essendo poco assorbita dai tessuti, penetra molto in profondità (oltre 10mm); questo fa sì che l’effetto termico necessario alla vaporizzazione sia molto ridotto a causa della dispersione della radiazione nel tessuto irradiato. Come conseguenza si produce una coagulazione profonda nell’area irradiata con formazione di edemi di notevoli dimensioni, con ostruzione prolungata del tratto urinario, con cateterizzazioni prolungate e grossi fastidi irritativi per i pazienti . Nonostante le problematiche emerse, questa procedura mise in luce alcuni dei principali vantaggi dell’uso delle tecnologie laser in urologia, quali la semplicità d’intervento e la validità dell’effetto coagulativo che il laser garantisce; ma in confronto alla TURP, la VLAP non ha comportato vantaggi o miglioramenti .
- TUEP (TransUrethral Evaporation of the Prostate)
Narayan e colleghi utilizzarono la sorgente Nd:YAG per una nuova tecnica nota come TUEP (Transurethral Evaporation of the Prostate), in cui veniva usata una fibra ortogonale in modalità a contatto, con potenze dell’ordine dei 60-80W, per ottenere la vaporizzazione dei lobi prostatici .
Kabalin et al., sperimentarono questa tecnica in vivo su prostate umane e canine. Osservando i risultati di queste sperimentazioni, i medici giunsero alla conclusione che l’effetto principale del laser Nd:YAG era quello di produrre grosse masse coagulate con 20mm di spessore, a causa del basso assorbimento della radiazione da parte dei tessuti.
- ILC (Interstitial Laser Coagulation)
Nel 1991 venne proposto da Hofstetter un nuovo approccio per la terapia della BPH, noto come ILC (Interstitial Laser Coagulation). Il trattamento ILC utilizza il laser al Nd:YAG a1064 nm o il laser a diodi INDIGO a 830nm, con una fibra dotata di una punta conica conficcata nell’adenoma prostatico, in grado di diffondere interstizialmente la radiazione nel tessuto. Il principio su cui si basa questa tecnica è quello della termoterapia: il riscaldamento interstiziale provoca la necrosi del tessuto che porta ad una riduzione del volume della prostata. Con questa procedura, si produce una coagulazione profonda nell’area irradiata con formazione di edemi di notevoli dimensioni, con ostruzione prolungata del tratto urinario, con cateterizzazioni prolungate e grossi fastidi irritativi per i pazienti . La tecnica ILC presentava anche un alto tasso di recidive nei successivi 3 anni. Successivamente alla ILC è stata associata la resezione del tessuto sottoposto al trattamento laser, questo ha consentito di ridurre i tempi di cateterizzazione ed il decorso postoperatorio.
- HoREP (Ho-YAG Laser Resection of the Prostate)
Alla fine degli anni ’90 sono stati sviluppati due trattamenti alternativi per l’uso del laser Ho:YAG nella cura della BPH. Si è scoperto, infatti, che la creazione quasi continua di bolle di plasma sullapunta della fibra piana, poteva essere utilizzata per tagliare il tessuto; inoltre, la bolla, rilasciando la sua energia nell’acqua circostante, generava uno spray di vapore e acqua calda in grado di produrre effetti di emostasi nell’intorno della zona irradiata.
Nacque in questo modo la tecnica (Ho:YAG Laser Resection of the Prostate), che mirava ad ottenere la resezione del tessuto prostatico transuretrale, utilizzando il laser ad olmio con potenze medie che vanno dai 45 ai 100W, con impulsi di durata di 500µsec e frequenze da 30 a 50 Hz . Questa procedura richiede un tempo maggiore di esecuzione rispetto alle altre tecniche proposte perché necessita che il tessuto asportato sia estratto dopo il trattamento laser. Lo sviluppo di strumenti per la rimozione del tessuto, come i morcellatori, ha abbassato i tempi dei trattamenti HoREP .
- TmLRP (Thulium Laser Resection of Prostate)
Il laser a tullio (Tm-YAG 2013 nm) nasce per essere utilizzato sui tessuti molli ed in special modo sulla prostata, grazie alla sua emissione intorno ai 2013 nm che risulta essere molto vicina al picco di assorbimento dell’acqua a 1970nm.
Meccanismo d’azione: il laser Tm:YAG emette in modalità continua un’onda con una lunghezza compresa tra 1940 e 2013 nm. Il laser nasce per l’utilizzo nei dispositivi antincendio
Dato che l’utilizzo endurologico prevede che l’estremità della fibra sia sempre immersa nell’acqua, e grazie al fatto che ogni tessuto contiene una elevata percentuale di questo cromoforo, la radiazione del tullio subisce un assorbimento elevatissimo, anche superiore a quello dell’olmio. Se la fibra lavora a contatto con i tessuti molli si ottiene una ablazione efficace, regolare e pulita. Inoltre l’acqua circostante la fibra si riscalda molto velocemente e produce un termo spray coagulativo nell’intorno del punto di irraggiamento. E’ importante tenere presente che la profondità dell’effetto di coagulazione è un parametro non omogeneo in quanto dipende dalla potenza usata e dal tempo di irraggiamento, ovvero dalla velocità di traslazione della punta della fibra laser sul tessuto trattato.
Chirurgia laser oggi
- Vaporizzazione della prostatata (PVP o Photoselective Vaporization of the Prostate)
Nel 1997 si sviluppò una tecnica per eseguire una asportazione dell’adenoma mediante vaporizzazione grazie all’uso del laser KTP-532 (seconda armonica del Nd-YAG a 1064nm) di alta potenza (60-100W). Le prime macchine avevano una potenza limitata (GreenLight® PV 80W) rispetto a quelle attuali ma consentivano un trattamento efficace di prostate non particolarmente voluminose. Nel 2007, l’introduzione di una nuova apparecchiatura, il GreenLight High Performance System (HPS) consentì, grazie all’utilizzo di un nuovo cristallo LBO (litio-triborato), di portare la potenza del laser a 120W e quindi di velocizzare le procedure di vaporizzazione anche in prostate di dimensioni maggiori. Infine, nel 2010, si è giunti a una ulteriore evoluzione della tecnologia: l’introduzione di una nuova apparecchiatura, il Greenlight XPS, e di una nuova fibra laser ha permesso di raggiungere la potenza di 180 W. La nuova fibra laser, Moxy, ha uno speciale canale che consente di raffreddare la punta stessa durante la procedura rendendola più efficace e ha una area di irraggiamento ingrandita del 50% rispetto alle fibre utilizzate in precedenza. La penetrazione nei tessuti dell’energia, rimane invariata mantenendo così le caratteristiche di sicurezza per il paziente per cui si erano distinte le precedenti apparecchiature Greenlight. La nuova apparecchiatura e la nuova fibra grazie alla maggiore efficacia nella vaporizzazione hanno quindi consentito di ottenere risultati eccellenti per ogni tipo di paziente e di prostata trattata.
La tecnica nota come PVP (Photoselective Vaporization of the Prostate) sfrutta l’assorbimento selettivo della radiazione da parte dell’emoglobina per vaporizzare il tessuto prostatico.
Si utilizza un laser ad emissione continua KTP a 532nm denominato “green laser”, la cui radiazione viene convogliata in una fibra ortogonale utilizzata in modalità “quasi contatto”. La vaporizzazione dell’adenoma prostatico con il laser KTP consente una ablazione veloce del tessuto. Per eseguire questo intervento si ricorre a un laser KTP settato ad una potenza di 60W e ad una fibra ortogonale inserita in un resettoscopio 22-24F, quindi di dimensioni contenute e facile da maneggiare. Con questa metodica, il tessuto viene completamente vaporizzato, pertanto non c’è la necessità di rimozione dei residui recisi, ma nemmeno la possibilità di eseguire alcun esame istologico. Recentemente la metodica PVP si avvale di sorgenti KTP con potenze superiori a 80W, che sembra producano un miglioramento globale operatorio e sui pazienti; tali risultati vanno però verificati. L’intervento con il laser KTP può portare inoltre ad alcune complicanze legate soprattutto a disturbi minzionali di tipo irritativo di durata limitata, ematuria tardiva, stenosi del collo vescicale, eiaculazione retrograda. Va chiarito un concetto fondamentale sulla radiazione emessa dal laser KTP/532: questa lunghezza d’onda è fortemente assorbita dal sangue e di conseguenza solo dai tessuti molto vascolarizzati. Sui tessuti vascolarizzati infatti la radiazione a 532 nm provoca un’ablazione veloce ed esercita un’ottima azione coagulativa, ma sui tessuti poco vascolarizzati la radiazione può attraversare 68 parecchi centimetri di tessuto subendo solo una modesta attenuazione e il rischio di produrre gravissimi retrodanni, in zone non visibili per via endoscopica, è altissimo. Inoltre questa lunghezza d’onda non subisce alcuna attenuazione dall’acqua, ambiente dove si opera in endourologia.
I vantaggi della vaporizzazione laser sono:
-migliora immediatamente il flusso urinario;
-richiede una degenza breve;
-richiede una cateterizzazione ridotta:
-presenta un basso rischio di complicanze;
-permette di continuare ad assumere farmaci che fluidificano il sangue.
Gli svantaggi sono:
-efficacia minore in caso di prostata voluminosa;
-dolore durante la minzione, dopo l’intervento chirurgico;
-necessità di ripetere l’intervento, a distanza di anni, poiché la prostata continua a crescere;
-impossibilità di analizzare il tessuto prostatico dopo l’intervento;
-rischio di eiaculazione retrograda;
-rischio di ritenzione urinaria, infezioni delle vie urinarie e urgenza minzionale;
-rischio (minimo) di incontinenza urinaria.
Meccanismo d’azione: i laser al Kalium-Titanyl-Fosfato (KTP) e triborato di litio (LBO) lavorano a una lunghezza d’onda di 532 nm. L’energia del laser viene assorbita dall’emoglobina, ma non dall’acqua. La vaporizzazione comporta una rimozione immediata del tessuto prostatico. Esistono 3 laser a “luce verde” che divergono tra loro non soltanto per il livello massimo di energia erogabile, ma anche per il design delle fibre e le modalità di interazione coi tessuti dell’energia trasmessa. La tecnica standard prevede il laser XPS a 180 W, tuttavia la maggior parte degli studi sono stati eseguiti valutando i precedenti sistemi laser KTP a 80 W o HPS a 120 W (LBO).
Efficacia e sicurezza: Non sono state riscontrate negli studi effettuati differenze che confrontavano la vaporizzazione prostatica foto-selettiva (PVP), utilizzando i laser a 80 W e a 120 W, con la TURP. in termini di Qmax e di IPSS tra la PVP a 80 W e la TURP; di questi 9 studi solo 3 fornivano dati sufficienti a 12 mesi per essere inseriti nella metanalisi (363-365). Un’altra metanalisi del 2016, di 4 RCT comprendenti 559 pazienti sul laser a 120 W, non ha mostrato differenze significative nei parametri funzionali e sintomatologici a 6, 12 e 24 mesi di follow-up rispetto alla TURP .
Il laser XPS a 180 W è non inferiore alla TURP in termini di riduzione dell’IPSS, aumento del Qmax, riduzio- ne del RPM e del volume della prostata, diminuzione del PSA e aumento della QoL. La PVP XPS a 180 W è superiore alla TURP in termini di tempo di cateterizzazione, durata della degenza ospedaliera e tempi di ripresa funzionale.
Un lungo RCT di confronto tra il laser HPS a 120 W e la TURP ha avuto un follow-up di 36 mesi e ha eviden- ziato un miglioramento paragonabile in termini di IPSS, Qmax e PVR tra le due procedure (368). Il tasso di re-intervento era invece significativamente più alto dopo PVP (11% vs. 1.8%; p = 0,04) (368). In 2 RCT con un follow-up massimo di 24 mesi, sono stati riportati miglioramenti simili riguardo IPSS, QoL, Qmax e parametri urodinamici.
- Vapo-Enuclazione con laser Tullio (ThuVEP)
Questa tecnica consente di ottenere l’enucleazione dei lobi prostatici grazie all’azione prevalente dell’ablazione laser, ottenuta tramite la vaporizzazione del tessuto antistante la punta della fibra ottica utilizzata, rispetto all’azione meccanica esercitata con lo strumento endoscopico. La componente di tessuto vaporizzato può superare il 50% del volume prostatico rimosso. L’utilizzo di questa tecnica va a vantaggio della riduzione dei fenomeni irritativi ed è più cautelativa nei pazienti con note problematiche di coagulazione.
Efficacia: Per quanto riguarda la ThuVEP sono stati condotti principalmente studi di tipo prospettico che hanno mostrato un miglioramento significativo in termini di IPSS, Qmax e PVR dopo il trattamento.
La ThuVEP ha mostrato un’elevata sicurezza intraoperatoria negli studi randomizzati nonché in case series di pazienti con prostate di grandi dimensioni e/o in trattamento con anticoagulanti o con anomalie della coagulazione. Il tempo di cateterizzazione, la degenza ospedaliera e le perdite di sangue sono risultati essere più brevi rispetto alla cTURP. La stenosi uretrale dopo ThuVEP si è verificata solo nell’1.6% e il tasso complessivo di ritrattamento è stato del 3.4% (follow-up medio di 16.5 mesi). Due studi (un caso-controllo e un RCT di confronto tra ThuVEP e TURP) hanno valutato l’impatto della ThuVEP sulla funzione sessuale, dimostrando che non esercita alcun effetto sulla EF, ma si associa ad un aumento della prevalenza di eiaculazione retrograda postoperatoria rispetto alla TURP. Un altro studio caso-controllo ha valutato l’impatto sulla EF sia della resezione che della enucleazione con laser al tullio. Lo score IIEF-5 è significativamente sceso durate i primi 3 mesi post-operatori per poi successivamente aumentare gradualmente, tornando ai livelli preoperatori al 12° mese di follow-up .
Tm:LRP-TT(Thulium Laser Resection of Prostate-Tangerine Technique).
Con questa tecnica è possibile ottenere la coagulazione del tessuto prostatico per uno spessore che va da 0.4 a 0.8 mm, assicurando un buon effetto emostatico, con un limitato danno termico.
Efficacia: 2 metanalisi hanno confrontato la ThuVARP con la M-TURP. La prima ha valutato i dati di di 3 RCT, 1 quasi-RCT e 2 studi caso-controllo. Sono stati inclusi anche studi relativi alla TURP mono e bipolare. Tutti i trattamenti si dimostravano efficaci con tuttavia un miglioramento dello score IPSS a 12 mesi più spiccato per la ThuVARP. La seconda metanalisi ha incluso i dati di 6 RCT e 3 studi retrospettici con diversi follow-up e con la sola B-TURP come elemento di paragone. Tra le 2 tecniche non si sono rilevate differenze significative in termini di IPSS, Qmax e RPM .
Tollerabilità e sicurezza: La ThuVARP, ha mostrato un’elevata sicurezza intraoperatoria negli studi randomizzati nonché in case series di pazienti con prostate di grandi dimensioni e/o in trattamento con anticoagulanti o con anomalie della coagulazione. Il tempo di cateterizzazione, la degenza ospedaliera e le perdite di sangue sono risultati essere più brevi rispetto alla TURP. Il tasso di stenosi uretrale post-operatoria dopo ThuVARP era dell’1.9%, il tasso di BNC era dell’1.8% e il tasso di re-intervento era compreso tra 0 e 7.1% durante il follow-up .
- Enucleazione adenoma prostata con laser olmio (HoLEP)
La tecnica, nota come HoLEP (Ho:YAG Laser Enucleation of the Prostate), fu introdotta come evoluzione della HoREP , utilizzando una potenza intorno agli 80-100W, con impulsi di durata di 500µsec e frequenze intorno ai 50Hz. Utilizzando la fibra ottica come bisturi, i lobi prostatici vengono enucleati nella loro interezza, spinti all’interno della vescica e poi frammentati e aspirati tramite il morcellatore. Con questa tecnica, vi è la possibilità di effettuare un esame istologico del tessuto asportato, in quanto la maggior parte di esso non risulta necrotizzato. Inoltre, durante la procedura, grazie al rilascio termico dell’energia del plasma nell’acqua, vasi di piccole e medie dimensioni vengono coagulati, per questo motivo non vi sono grossi sanguinamenti.
Meccanismo d’azione: il laser olmio:yttrio-alluminio-garnet (Ho:YAG) (lunghezza d’onda di 2.140 nm) è un laser pulsato a stato solido che viene assorbito dall’acqua e da tessuti contenenti acqua. La coagulazione tissutale e la necrosi sono limitate a 3-4 mm di profondità, il che è sufficiente per ottenere un’emostasi adeguata.
Efficacia: le metanalisi che comprendono studi sulla HoLEP vs. TURP hanno rilevato che il miglioramento dei sintomi era equiparabile e persino superiore con la tecnica HoLEP. Un RCT che metteva in confronto la HoLEP con la TURP in un piccolo numero di pazienti lungo un periodo di 7 anni di follow up ha registrato risultati funzionali a lungo termine sovrapponibili per le due tecniche. Studi controllati randomizzati indicano che la HoLEP è efficace quanto l’adenomectomia open riguardo al miglioramento della minzione in pazienti con grandi volumi prostatici con simili risultati in termini di miglioramento del Qmax, dello score IPSS e dei tassi di re-intervento a 5 anni. Tollerabilità e sicurezza: rispetto alla TURP, la HoLEP si associa a tempi di cateterizzazione e ospedalizzazione più brevi. L’HoLEP si accompagna a un tempo di cateteriz-zazione e una degenza ospedaliera più brevi, ridotte perdite ematiche ed un minor numero di trasfusioni, ma anche una durata operatoria maggiore rispetto alla TURP. Non sono state notate differenze significative tra HoLEP e TURP per quanto riguarda la stenosi uretrale (2.6% vs. 4.4%), l’incontinenza urinaria da sforzo (1.5% vs. 1.5%) e le percentuali di re-intervento (4.3% vs. 8.8%).
- Enucleazione adenoma prostate con laser Tullio (ThuLEP)
Nel trattamento della prostata, il laser a tullio è stato utilizzato per la resezione prostatica, per l’enucleazione della prostata, con una metodica simile invece all’HoLEP. Anche se le tecniche sfruttano gli stessi principi, il tullio rispetto all’olmio mostra più vantaggi, legati principalmente al fatto che si opera in modalità continua. Grazie a queste caratteristiche, si è dimostrato che con il tullio si ottiene una rapida vaporizzazione e coagulazione del tessuto prostatico. L’energia termica prodotta dal tullio sull’estremità della fibra è molto minore di quella prodotta dall’olmio, pertanto il rischio di produrre edemi durante l’ablazione prostatica è minore rispetto all’olmio. La metodica associata all’uso del laser a tullio è chiamata ThuLEP.
La tecnica di enucleazione prevede lo “scollamento” dei lobi prostatici ostruenti tramite un’azione meccanica, ottenuta aiutandosi con lo strumento endoscopico ed utilizzando il laser per tagliare/ablare le componenti tissutali resistenti agendo sui punti di eventuale sanguinamento tramite una rapida azione laser emostatica. Conseguentemente alla procedura di enucleazione è necessario agire con un sistema morcellatore per l’eliminazione dei lobi traferiti in vescica.
Efficacia: La ThuLEP e l’enucleazione bipolare sono stati confrontati in un RCT con 12 mesi di follow-up. Lo studio non ha mostrato differenze tra le due procedure riguardo l’efficacia mentre la diminuzione dei livelli di emoglobina e il tempo di cateterizzazione erano significativamente inferiori con la tecnica ThuLEP. Un RCT con follow-up di 5 anni ha confrontato ThuLEP e B-TURP senza evidenza di differenze significative tra le due tecniche riguardo Qmax, IPSS, PVR e QoL. Il tasso di abbandono a 5 anni è stato del 50% .
Tollerabilità e sicurezza: La ThuLEP ha mostrato un’elevata sicurezza intraoperatoria negli studi randomizzati nonché in case series di pazienti con prostate di grandi dimensioni e/o in trattamento con anticoagulanti o con anomalie della coagulazione. Il tempo di cateterizzazione, la degenza ospedaliera e le perdite di sangue sono risultati essere più brevi rispetto alla TURP. In due RCT su ThuLEP vs TURP, in un RCT su ThuLEP vs. enucleazione bipolare e in un RCT su ThuLEP vs HoLEP, la ThuLEP si è mostrata equivalente in tutti i casi in termini di capacità emostatica. Le stesse evidenze si sono rivelate per ThuVEP vs. TURP in un RCT. In 2 successivi RCT su ThuLEP vs. HoLEP non si sono evidenziate significative differenze a 6, 12 e 18 mesi di follow-up.
TRATTAMENTI ALTERNATIVI
- Impianto disostruttivo uretrale prostatico “UROLIFT”
Il dispositivo PUL (Urolift) può essere proposto a uomini con LUTS interessati a preservare la funzionalità eiaculatoria, con prostate < 70 ml di volume e in assenza di lobo medio.
Meccanismo d’azione: l’impianto disostruttivo uretrale prostatico Urolift (PUL) rappresenta una nuova metodica mininvasiva, eseguita in anestesia locale o generale. I voluminosi lobi laterali della prostata vengono compressi da piccoli impianti permanenti (Urolift®), posizionati con l’ausilio del cistoscopio, risultando in un’apertura continua anteriore lungo l’uretra prostatica dal collo vescicale al veru montanum.
Il sistema UroLift consiste di due componenti principali:
Dispositivo di inserimento UroLift. Viene introdotto per via transuretrale attraverso una guaina rigida sotto visualizzazione cistoscopica per raggiungere l’area bersaglio dell’ostruzione. Ciascun dispositivo di inserimento UroLift contiene un impianto UroLift.
Impianto UroLift. I lobi prostatici causa dell’ostruzione vengono aperti da impianti UroLift permanenti di ridottissime dimensioni che vengono posizionati dal dispositivo di inserimento. Ciascun impianto è fabbricato impiegando comuni materiali impiantabili: Nitinol, acciaio inossidabile e sutura in polietilene (PET). In genere, vengono posizionati quattro impianti nella prostata.
Efficacia: in generale, il PUL determina un netto miglioramento dell’IPSS (da -39% a -52%), del Qmax (da +32% a +59%) e della QoL (da -48% a -53%) . L’endpoint primario si è raggiunto al terzo mese con una riduzione dello score IPSS del 50%. Miglioramenti del PVR non sono stati invece rilevati rispetto ai valori di partenza e al gruppo di controllo. A 3 anni, i miglioramenti rispetto ai valori di partenza sono stati in media consistenti per quanto riguarda IPSS totale, QoL, Qmax e i singoli domini dello score IPSS. Con il PUL non si sono verificati eventi indesiderati di nuova insorgenza riguardanti l’eiaculazione e la funzionalità erettile e tutte le valutazioni della sfera sessuale hanno dimostrato stabilità se non addirittura un miglioramento delle funzioni sessuali.
Tollerabilità e sicurezza: le complicanze post-operatorie più comuni hanno incluso l’ematuria (16-63%), la disuria (25-58%), il dolore pelvico (5-17.9%), l’urgenza minzionale (7.1-10%), l’incontinenza transitoria (3.6-16%) e le IVU (2.9-11%) (428, 431-433). La maggior parte dei sintomi era di entità lieve/moderata e si è risolta entro 2-4 settimane dalla procedura. Il PUL sembra non avere alcun impatto sulla funzionalità sessuale. La valutazione della funzionalità ses- suale con IIEF-5, Male Sexual Health Questionnaire-Ejaculatory Disfunction e Male Sexual Health Questio- naire-Bother in pazienti sottoposti a PUL ha mostrato che la funzionalità erettile ed eiaculatoria venivano mantenute (426-430).
- (i)TIND
La procedura iTind™ si adatta perfettamente ai pazienti che non desiderano essere sottoposti a costante prescrizione farmacologica per l’ipertrofia prostatica, all’impianto permanente di un dispositivo o che non sono ancora pronti per l’intervento chirurgico, con LUTS interessati a preservare la funzionalità eiaculatoria, con prostate < 70 ml di volume e in assenza di lobo medio.
Principi di base: iTIND è un device progettato per rimodellare il collo vescicale e l’uretra prostatica ed è costituito da 3 anse allungate e un dispositivo di ancoraggio, entrambi in nitinol. Viene posizionato sotto vista all’interno della prostata e così fissato in configurazione aperta. Concettualmente il meccanismo d’azione risiede nella compressione del tessuto ostruente dalle maglie aperte del device e contestualmente nella necrosi ischemica conseguente la forza radiale esercitata dalle stesse su specifiche aree di interesse. Viene mantenuto in posizione per 5 giorni per essere poi rimosso in sede ambulatoriale con cistoscopia standard. Le incisioni sul tessuto prostatico che ne risultano sono simili all’incisione di Turner-Warwick.
Efficacia: riproducibilità e sicurezza della procedura sono state valutate in uno studio prospettico a singolo braccio comprensivo di 32 pazienti con un follow-up di 3 anni. Ad ogni singolo follow-up le modifiche di IPSS, QoL e Qmax, rispetto ai valori di partenza, sono risultate significative.
Tollerabilità e sicurezza: tutti i pazienti hanno ben tollerato il dispositivo. Sono state registrate 4 complicanze precoci (12.5%) tra cui 1 AUR (3.1%), 1 episodio di incontinenza urinaria transitoria per dislocamento del device (3.1%) e 2 IVU (6.2%). Nessuna ulteriore complicanza si è verificata nel corso dei 36 mesi di follow-up.
- Rezum System: ablazione per mezzo dell’energia convettiva del vapore acqueo (WAVE ablation)
REZUM è un trattamento innovativo per curare l’ipertrofia prostatica benigna sviluppato negli Stati Uniti e approdato in Europa nel 2017-2018: nasce come terapia alternativa all’intervento chirurgico di asportazione dell’ipertrofia prostatica ostruttiva. Il trattamento con Rezum è indicato in pazienti selezionati, preferibilmente non affetti da sintomatologia severa o con prostate eccessivamente voluminose o condizioni di marcata infiammazione delle basse vie urinarie
La terapia con vapore acqueo è una procedura mini-invasiva che usa l’energia naturale immagazzinata in poche gocce d’acqua: in questo modo è possibile eliminare l’eccesso di tessuto prostatico che causa i sintomi urinari.
Le indicazioni al trattamento sono per prostate fino a 80 ml di volume, anche con lobo medio voluminoso; mentre è controindicato per i portatori di protesi peniene o sfinteriali.
Principi di base: il sistema Rezum sfrutta le radiofrequenze per rilasciare energia termica sotto forma di vapor d’acqua che a sua volta deposita l’energia termica accumulata quando dalla fase di vapore passa alla fase liquida al contatto con le cellule. Il vapore si disperde nell’interstizio prostatico e rilascia l’energia termica con conseguente necrosi tissutale. La procedura può essere svolta ambulatorialmente. Di norma devono essere eseguite da 1 a 3 applicazioni per ciascun lobo laterale e da 1 a 2 applicazioni per il lobo medio.
Efficacia: A 3 mesi, il sollievo dai sintomi misurato attraverso lo score IPSS e il Qmax è stato significativamente maggiore e stabilmente presente per i pazienti trattati con Rezum. Riguardo il RPM non c’è stato un cambiamento significativo. I parametri relativi alla qualità di vita sono migliorati consistentemente, con un tasso di risposta al trattamento del 52% a 12 mesi (p < 0.0001).
Tollerabilità e sicurezza: il profilo di sicurezza è adeguato con eventi indesiderati di grado lieve/moderato e rapidamente autolimitanti. Con l’ausilio di score validati quali IIEF e Male Sexual Health Questionnaire-Ejaculation Disorder Questionnaire si è dimostrata la capacità della tecnica di preservare la funzione erettile ed eiaculatoria
La terapia con Rezum rappresenta la nuova frontiera del trattamento mini-invasivo dell’Ipertrofia prostatica, che può essere eseguito in regime di day hospital.
Attraverso una sonda inserita dal pene (per via transuretrale) i lobi prostatici adenomatosi vengono vaporizzati per mezzo di un sottile ago. L’energia termica diffusa dall’ago nell’interstizio del tessuto prostatico per convezione determina la rottura delle membrane cellulari. La procedura dura pochissimi minuti (difficilmente supera i 5-10 minuti).
Può essere eseguita con anestesia locoregionale senza necessità di anestesia generale.
Nell’arco di qualche settimana l’effetto termico produce una importante riduzione del volume prostatico, con effetto disostruttivo. Il paziente viene dimesso poche ore dopo l’intervento con un catetere vescicale che viene rimosso dopo alcuni giorni a seconda del quadro clinico.
Il trattamento con Rezum potrebbe determinare dopo l’intervento effetti collaterali con sintomatologia urinaria irritativa della durata variabile da alcuni giorni ad un mese tra cui: difficoltà alla minzione, bruciore urinario, minzioni frequenti (pollachiuria), nicturia (minzioni notturne).
Normalmente verrà somministrata una terapia antibiotica ed antinfiammatoria.
A distanza di circa un mese si ottengono i primi benefici del trattamento con una risoluzione della sintomatologia ostruttiva ed irritativa presente prima dell’intervento contestualmente ad un aumento dell’intensità del flusso urinario.
Il risultato definitivo si ottiene dopo circa 2-3 mesi.
- Embolizzazione dell’arteria prostatica (PAE)
E’ essenziale un approccio multidisciplinare e un’attenta selezione del paziente da parte di urologo e radiologo interventista. La valutazione dei sintomi e l’indicazione a una procedura terapeutica invasiva sono invece ad appannaggio dell’urologo. La PAE è una procedura tecnicamente complessa che richiede la mano di un radiologo interventista competente e con specifica esperienza alla sua esecuzione. Pazienti con prostate voluminose (> 80 ml) sono quelli che possono trarre il beneficio maggiore. La modalità di selezione dei pazienti cui è maggiormente indicata la PAE resta ancora da definirsi adeguatamente. Ulteriori studi con follow-up a medio e lungo termine sono necessari e permetteranno di paragonare la tecnica con altre procedure mini-invasive per il trattamento della BPO. I dati ad oggi disponibili sull’efficacia e la sicurezza della PAE ne garantiscono e giustificano l’indicazione a pazienti con LUTS moderati/severi, purché siano previste adeguate modalità di descrizione delle caratteristiche della procedura e di raccolta del consenso.
Principi di base: l’embolizzazione dell’arteria prostatica (PAE) può essere eseguita in regime di day-surgery in anestesia locale con accesso tramite l’arteria femorale o radiale. L’angiografia digitale di sottrazione permette di visualizzare l’albero vascolare prostatico e di embolizzarlo selettivamente. Esistono differenti tecniche. Fattori anatomici che possono ostacolare la riuscita della PAE sono le placche aterosclerotiche, l’eccessiva tortuosità dei rami arteriosi della ghiandola e la presenza di vasi collaterali. La tomografia computerizzata a fascio conico (cone beam computed tomography, CBCT) può venire in aiuto nell’identificare le arterie prostatiche e prevenire le embolizzazioni off-target, soprattutto in pazienti con configurazioni vascolari di arduo approccio.
Efficacia: La PAE si è associato un miglioramento dello score IPSS a 12 mesi. Il tasso di riduzione del volume prostatico con PAE è stato del 28%.
Tollerabilità e sicurezza: La PAE fosse maggiormente associata ad eventi avversi rispetto a TURP e adenomectomia open (36 vs 70 eventi, p = 0.003). Dal punto di vista degli outcomes secondari, la PAE si è dimostrata favorevole in termini di perdite ematiche. Restano dubbi circa la questione delle embolizzazioni off-target riportate da recenti studi, ma che rimangono tuttavia poco frequenti
Approccio “open” transvescicale
- Adenomectomia con tecnica “open”
L’adenomectomia open è la tecnica chirurgica più invasiva, ma resta una procedura efficace e duratura per il trattamento dei LUTS dovuti ad ostruzione prostatica benigna. In assenza di una strumentazione endourologica comprensiva di laser ad olmio o sistema bipolare, l’adenomectomia open resta il trattamento chirurgico di scelta per gli uomini con volumi prostatici > 80 ml.
Meccanismo d’azione: l’adenomectomia open è la più datata tecnica chirurgica per il trattamento dei LUTS moderati/severi secondari ad ostruzione prostatica benigna. Gli adenomi ostruttivi vengono enucleati usando il dito indice della mano, accedendo dall’interno della vescica (procedura di Freyer) o dalla capsula prostatica anteriore (procedura di Millin). Questo approccio viene di solito riservato a pazienti con volumi prostatici al di sopra degli 80-100 mL.
Efficacia: l’adenomectomia open riduce i LUTS del 63-86% (12.5-23.3 punti IPSS), migliora il punteggio della QoL del 60-87%, aumenta il Qmax medio del 375% (+ 16.5-20.2 ml/s) e riduce il PVR dell’86-98%. L’efficacia è mantenuta fino a 6 anni .
Tollerabilità e sicurezza: la mortalità associata a adenomectomia open è diminuita significativamente negli ultimi due decenni (< 0.25%). Il tasso di re-intervento endoscopico successivo a adenomectomia è stato dello 0.9% a 3 mesi, 3.0% a 1 anno, 6.0% a 5 anni e 8.8% a 8 anni. La corrispondente incidenza di re-TURP è stata dello 0.5%, 1.8%, 3.7% e 4.3%. Il tasso di trasfusioni è del 7-14%. Le complicanze a lungo termine includono l’incontinenza urinaria transitoria (fino al 10%), la contrattura del collo della vescica e la stenosi uretrale (circa il 6%).
L’adenomectomia prostatica transvescicale è un intervento chirurgico “a cielo aperto”, vale a dire che viene eseguito attraverso l’apertura della cavità addominale.
L’indicazione all’intervento chirurgico “a cielo aperto” (rispetto all’intervento endoscopico TURP) viene decisa in rapporto all’eccessivo volume della prostata, alla presenza di voluminosi diverticoli e calcoli vescicali o a causa di una grave artrosi delle anche che impedisce il posizionamento del paziente a gambe divaricate, necessario per l’intervento endoscopico.
L’intervento può essere eseguito in anestesia generale o spinale, ha durata variabile tra 30 e 60 minuti. L’accesso chirurgico prevede un’incisione sull’addome o sovrapubica trasversale tipo incisione sec Pfannestiel o tra l’ombelico e il pube o longitudinale, che permettono divaricati i piani muscolari, di accedere allo spazio di Retzius e quindi alla vescica. La vescica viene incisa longitudinalmente e visualizzati gli osti uretereli e la barra interureterica, si procede poi alla rimozione dell’adenoma, lasciando in sede la restante parte della ghiandola prostatica.
Al termine dell’intervento si posiziona un catetere vescicale “a 3 vie” che, attraverso un’irrigazione continua, consente il lavaggio della cavità vescicale da coaguli di sangue; il lavaggio viene sospeso quando le urine sono limpide, in genere in un tempo compreso tra 24 e 72 ore dall’intervento. Viene occasionalmente posizionato un drenaggio (ovvero un tubo di silicone che ha lo scopo di consentire la fuoriuscita di sangue o altri liquidi dalla sede di intervento) collegato a una sacca di raccolta.
Se il decorso post-operatorio è regolare, il Paziente può iniziare l’alimentazione e la mobilizzazione dopo 12-24 ore; abitualmente la ferita viene medicata dopo 3 giorni; la rimozione dei punti di sutura è completata entro 7 giorni.
Mediamente dopo 5-7 giorni, in assenza di complicanze, vengono rimossi il catetere vescicale e, successivamente, e qualora presente il drenaggio , rimosso e successivamente dimesso il paziente. La degenza media è di 6-8 giorni.
Dopo la dimissione è suggerito un periodo di convalescenza (ridotto stress fisico, scarsa attività sessuale e/o sportiva, regime alimentare moderato, terapia antibiotica urinaria) con l’astensione dalle normali attività lavorative per periodo variabile tra 7 e 21 giorni. È consigliabile in questo periodo evitare lunghi tragitti in auto nonché l’uso di cicli e motocicli.
Il controllo postoperatorio viene effettuato entro 30-45 giorni e, in assenza di particolari situazioni cliniche, non è necessario programmare successive visite.